
| A.观察KCl溶液没有颜色 |
| B.向FeCl3溶液中滴加适量NaOH溶液,振荡静置,过滤后所得滤液黄色消失 |
| C.向FeCl3溶液中滴加适量AgNO3溶液,振荡静置,过滤后所得滤液黄色未消失 |
| D.加水稀释后FeCl3溶液黄色变浅 |
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
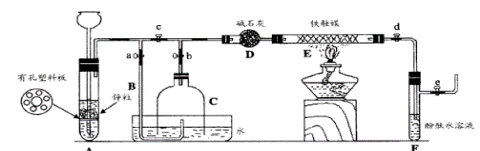






 :
:查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.氧气不纯(或没收集满) |
| B.火柴太长消耗了氧气 |
| C.铁丝表面有氧化物(或铁锈) |
| D.没有预热末端铁丝,温度没有达到铁丝的着火点 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所消耗的铜的质量相等 |
| B.所消耗的硝酸的量:①>②>③ |
| C.对环境造成的危害,③最小 |
| D.制取硝酸铜的最佳方案是① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
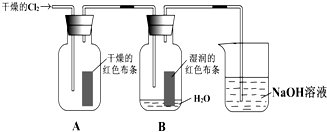
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | Ⅱ | 良 |
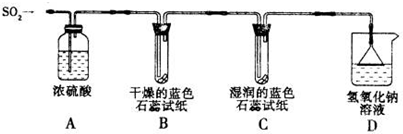
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
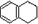 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: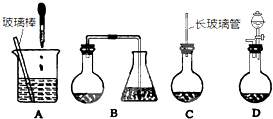
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com