
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中![]() 键与
键与![]() 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
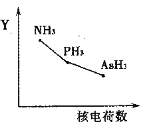
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
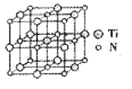
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
【答案】[Ar]3d6 F>O>As ad sp 1:1 FeF3为离子晶体,FeCl3为分子晶体 ac Ti4CN3
【解析】
(1)根据核外电子排布规律推知基态Fe2+的核外电子排布式;
(2)根据元素周期律可知,非金属性越强,电负性越大,据此答题;
(3)①(NH4)3FeF6是离子化合物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,据此答题;
②SCN-的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,据此答题;
(4)分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,据此答题;
(5)①a.根据元素周期律可知,非金属性越强,氢化物的稳定性越强;
b.氨气分子间存在氢键;
c.非金属性越强与氢元素形成的共价键越强,键能越大;
d.分子间作用力随相对分子质量的增加而增大;
②根据晶胞结构图利用均摊法可知,在晶胞中含有碳原子数、含有氮原子数、含有钛原子数,据此写出化学式。
(1)亚铁离子的核外电子数是24,因此根据核外电子的排布规律可知,基态Fe2+的核外电子排布式为[Ar]3d6。
(2)非金属性越强,电负性越大,则根据元素周期律可知氟、氧、砷三种元素中电负性值由大到小的顺序是F>O>As。
(3)①(NH4)3FeF6是离子化合物,存在的微粒间作用力除共价键外还有离子键,另外还有配位键,即N和H、Fe与F之间存在配位键,答案选ad。
②已知SCN一中各原子最外层均满足8电子稳定结构,则碳元素分别与S以及N元素形成1个双键,不存在孤对电子,因此C原子的杂化方式为sp杂化;由于单键都是![]() 键,双键是由1个
键,双键是由1个![]() 键与1个
键与1个![]() 键构成的,则该原子团中
键构成的,则该原子团中![]() 键与
键与![]() 个数的比值为1:1。
个数的比值为1:1。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,这说明氯化铁形成的晶体是分子晶体,而FeF3晶体熔点高于1000oC,这说明氟化铁形成的晶体类型是离子晶体,因此两种化合物熔点差异较大的原因是FeF3为离子晶体,FeCl3为分子晶体。
(5)①a.非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;
b.由于氨气分子间存在氢键,因此氨气的沸点最高,b不正确;
c.非金属性越强与氢元素形成的共价键越强,键能越大,因此R—H键能虽原子序数的增大而减小,c正确;
d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,d不正确;
答案选ac。
②根据晶胞的结构特点并依据均摊法可知,晶胞中含有的碳原子数是8×![]() =1,氮原子数6×
=1,氮原子数6×![]() =3,钛原子数是12×
=3,钛原子数是12×![]() +1=4,所以化学式为Ti4CN3。
+1=4,所以化学式为Ti4CN3。


科目:高中化学 来源: 题型:
【题目】(10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玉溪一中某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。

已知:298 K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为________,固体A为________(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式_________________。
(3)调节pH至2.9~3.2的目的是分离________(填离子符号)。
(4)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_____________________。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为____________(填化学式)。
(6)红棕色固体C的用途____________________(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g)![]() CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。

①当起始n(H2)/n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=________。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图像中的____点(填“D”“E”或“F”)。
③由图2可知该反应的ΔH________0(填“>”“<”或“=”),理由是______________;当压强为p2时,在y点:v正________v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
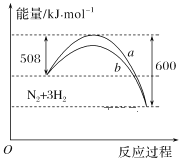
A.在温度、体积一定的条件下,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2molN2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1
B.该反应的热化学方程式为:N2+3H22NH3 ΔH=-92kJ·mol-1
C.a曲线是加入催化剂时的能量变化曲线
D.加入催化剂,该化学反应的反应热改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )
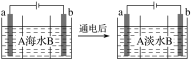
A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。

①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com