
下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是
A.VSEPR模型可用来预测分子的立体结构
B.分子中价电子对相互排斥决定了分子的空间结构
C.分子中键角越大,价电子对相互排斥力越小,分子越稳定
D.中心原子上的孤电子对不参与互相排斥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ —— Mn2+ + CO2↑+ H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| A | 2 mL | 20 | |
| B | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| C | 2 mL | 30 | |
| D | 1 mL | 20 | V1 mL蒸馏水 |
| E | 0.5 mL | 20 | V2 mL蒸馏水 |
(1)完成上述实验方案设计,其中: V1= ,V2= ;
(2) 如果研究温度对化学反应速率的影响,使用实验 和 。
(3) 甲同学在做A组实验时,发现反应开始时速率较慢,随后加快。他分析认为高锰酸钾与
草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,
你猜想还可能是 ;
Ⅱ.乙同学利用下图测定反应速率

回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 仪来记录数据。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z为3种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为
2Z达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为
A. ×100% B.
×100% B. ×100%
×100%
C.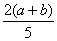 ×100% D.
×100% D. ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)已知在448℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K1为49,则该温度下 反应
2HI(g)的平衡常数K1为49,则该温度下 反应 H2(g)+
H2(g)+ I2(g)
I2(g) HI(g)的平衡常数K2为__________。
HI(g)的平衡常数K2为__________。
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________。
(2)该反应为__________反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是( )。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D. c(CO2)=c(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中不正确的是
A.甲醇分子内C原子的杂化方式为sp3杂化
B.甲醇分子内的O—C—H键角大于甲醛分子内的O—C—H键角
C.甲醛分子内C原子上无孤对电子
D.甲醛分子两个C—H键夹角小于120°
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1) 在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(2) Y与Z可形成YZ42-,YZ42-的空间构型为 (用文字描述)。
(3) X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有配位键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:

下列叙述不正确的是
A. 放电时负极反应为:Zn - 2e— + 2OH— == Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3 -3e— + 5OH— == FeO42— + 4H2O
C. 放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.Fe在少量Cl2中燃烧生成FeCl2,在足量Cl2中燃烧生成FeCl3
B.在空气中用小火慢慢加热蒸干硫酸亚铁溶液,不会得到纯净的硫酸亚铁固体,
C.鉴别Fe2+和Fe3+,可以使用酸性KMnO4溶液 ,也可使用KI淀粉溶液
D.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com