
ЎҫМвДҝЎҝВИјоі§өзҪвұҘәНКіСОЛ®ЦЖИЎNaOHөД№ӨТХБчіМКҫТвНјИзПВЈә

ТАҫЭЙПНјЈ¬НкіЙПВБРМоҝХЈә
ЈЁ1Ј©ҙУәЈЛ®ЦР»сИЎҙЦСОөД·Ҫ·ЁКЗ___ЎЈ
ЈЁ2Ј©Ў°ҫ«ЦЖЎұ№ӨРтЦРЈ¬УыіэИҘҙЦСОЛ®ЦРөДCa2+ЎўMg2+ј°SO42-Ј¬ҝЙҪшРРөДІЩЧчУРЈә
A. №эВЛ
B. јУ№эБҝBaCl2ИЬТә
C. јУККБҝПЎСОЛб
D. јУ№эБҝNaOHИЬТә
E. јУ№эБҝNa2CO3ИЬТә
ўЩХэИ·ІЩЧчөДЛіРтКЗ___(МоЧЦДё)ЎЈ
ўЪІЩЧчBөДДҝөДКЗ___
ўЫІЩЧчCөДДҝөДКЗ___
ўЬІЩЧчDЦР·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪКЗ___
ўЭҙЛІЩЧчЦРөДПЎСОЛбДЬ·сУГПЎПхЛбҙъМж?____(МоЎ°ДЬЎұ»тЎ°·сЎұ)Ј¬АнУЙКЗ___ЎЈ
ЈЁ3Ј©јмСйЎ°өзҪвЎұәуөДИЬТәЦРИФИ»ә¬УРNaClөД·Ҫ·ЁКЗ___Ј¬№ЫІмөҪөДПЦПуКЗ___ЎЈ
ЈЁ4Ј©Ў°НССОЎ°№ӨРтЦРЈ¬НЁ№эјУИИЕЁЛхЎўАдИҙҪбҫ§Ўў___өД·Ҫ·ЁіэИҘNaClЈ¬ёГ·Ҫ·ЁөДФӯАнКЗПаН¬ОВ¶ИПВNaClУлNaOHөДИЬҪв¶ИІ»Н¬Ј¬ФЪёГІЩЧчОВ¶ИПВЈ¬ИЬҪв¶ИҪПҙуөДКЗ___ЎЈ
ЈЁ5Ј©ЙПКц№ӨТХЦРҝЙСӯ»·К№УГөДОпЦККЗ______ЎЈ(Мо»ҜС§КҪ)ЎЈ
Ўҫҙр°ёЎҝХф·ўҪбҫ§ BDEAC(»тBEDAC) іэИҘИЬТәЦРSO42- іэИҘИЬТәЦРөДМјЛбДЖәНЗвСх»ҜДЖ Mg2++2OH-= Mg(OH)2Ўэ ·с »бТэИлNO3-ФУЦК ИЎЙЩБҝөзҪвәуөДИЬТәЈ¬ПтЖдЦРөОИлПЎПхЛбЛб»ҜЈ¬ФЩөОјУПхЛбТшИЬТә өОјУПхЛбТшИЬТәәуІъЙъ°ЧЙ«іБөн №эВЛ NaOH NaClәНNaOH
ЎҫҪвОцЎҝ
(1)ёщҫЭҙУИЬТәЦР»сөГИЬЦКөД·Ҫ·Ё·ЦОцҪвҙрЈ»
(2)іэИҘҙЦСОЛ®ЦРөДCa2+ЎўMg2+ј°SO42-Ј¬Т»°гјУИлNaOHИЬТәКЗіэИҘГҫАлЧУЈ¬јУBaCl2ИЬТәКЗіэИҘБтЛбёщАлЧУЈ¬јУNa2CO3ИЬТәКЗіэИҘёЖАлЧУәН№эБҝөДұөАлЧУЈ¬ТтҙЛЈ¬Na2CO3ИЬТәТ»¶ЁФЪBaCl2ИЬТәЦ®әујУИлЈ¬ОӘБЛІ»К№ІъЙъөДіБөнИЬҪвЈ¬Т»¶ЁТӘФЪ№эВЛәуФЩјУСОЛбҫЭҙЛ·ЦОцҪвҙрЈ»
(3)јмСйЎ°өзҪвЎұәуөДИЬТәЦРИФИ»ә¬УРNaClЈ¬Ц»РиТӘјмСйә¬УРВИАлЧУјҙҝЙЈ»
(4)ПаН¬ОВ¶ИПВNaClУлNaOHөДИЬҪв¶ИІ»Н¬Ј¬ВИ»ҜДЖөДИЬҪв¶ИЛжЧЕОВ¶Иұд»ҜІ»ҙуЈ¬ЗвСх»ҜДЖИЬҪв¶ИҪПҙуЈ¬ЗТЛжОВ¶ИөДұд»ҜҪПҙуЈ¬ҫЭҙЛ·ЦОцҪвҙрЈ»
(5)ёщҫЭБчіМНј·ЦОц№ӨТХЦРҝЙСӯ»·К№УГөДОпЦКЎЈ
(1)ҙУәЈЛ®ЦР»сИЎҙЦСОЈ¬ҝЙТФНЁ№эХф·ўҪбҫ§өД·Ҫ·ЁөГөҪЈ¬№Кҙр°ёОӘЈәХф·ўҪбҫ§Ј»
(2)ўЩЎ°ҫ«ЦЖЎұ№ӨРтЦРЈ¬іэИҘҙЦСОЛ®ЦРөДCa2+ЎўMg2+ј°SO42-Ј¬јУИлNaOHИЬТәКЗіэИҘГҫАлЧУЈ¬јУBaCl2ИЬТәКЗіэИҘБтЛбёщАлЧУЈ¬јУNa2CO3ИЬТәКЗіэИҘёЖАлЧУәН№эБҝөДұөАлЧУЈ¬ТтҙЛЈ¬Na2CO3ИЬТәТ»¶ЁФЪBaCl2ИЬТәЦ®әујУИлЈ¬ОӘБЛІ»К№ІъЙъөДіБөнИЬҪвЈ¬Т»¶ЁТӘФЪ№эВЛәуФЩјУСОЛбЈ¬ХэИ·ІЩЧчөДЛіРтКЗBDEAC»тBEDACЈ¬№Кҙр°ёОӘЈәBDEAC(»тBEDAC)Ј»
ўЪІЩЧчBјУ№эБҝBaCl2ИЬТәКЗОӘБЛіэИҘБтЛбёщАлЧУЈ¬№Кҙр°ёОӘЈәіэИҘИЬТәЦРSO42-Ј»
ўЫІЩЧчCјУККБҝПЎСОЛбЈ¬ОӘБЛіэИҘИЬТәЦРөДМјЛбДЖәНЗвСх»ҜДЖЈ¬№Кҙр°ёОӘЈәіэИҘИЬТәЦРөДМјЛбДЖәНЗвСх»ҜДЖЈ»
ўЬІЩЧчDјУ№эБҝNaOHИЬТәКЗОӘБЛіэИҘMg2+Ј¬·ҙУҰөДАлЧУ·ҪіМКҪОӘMg2++2OH-= Mg(OH)2ЎэЈ¬№Кҙр°ёОӘЈәMg2++2OH-= Mg(OH)2ЎэЈ»
ўЭИз№ыУГПЎПхЛбҙъМжПЎСОЛбЈ¬»бТэИлNO3-ФУЦКЈ¬№Кҙр°ёОӘЈә·сЈ»»бТэИлNO3-ФУЦКЈ»
(3)јмСйЎ°өзҪвЎұәуөДИЬТәЦРИФИ»ә¬УРNaClЈ¬Ц»РиТӘјмСйә¬УРВИАлЧУјҙҝЙЈ¬·Ҫ·ЁОӘЈәИЎЙЩБҝөзҪвәуөДИЬТәЈ¬ПтЖдЦРөОИлПЎПхЛбЛб»ҜЈ¬ФЩөОјУПхЛбТшИЬТәЈ¬ИфіцПЦ°ЧЙ«іБөнЈ¬ЦӨГчә¬УРNaClЈ¬№Кҙр°ёОӘЈәИЎЙЩБҝөзҪвәуөДИЬТәЈ¬ПтЖдЦРөОИлПЎПхЛбЛб»ҜЈ¬ФЩөОјУПхЛбТшИЬТәЈ»өОјУПхЛбТшИЬТәәуІъЙъ°ЧЙ«іБөнЈ»
(4)Ў°НССОЎ°№ӨРтЦРЈ¬НЁ№эјУИИЕЁЛхЎўАдИҙҪбҫ§Ўў№эВЛөД·Ҫ·ЁіэИҘNaClЈ¬ФӯАнКЗПаН¬ОВ¶ИПВNaClУлNaOHөДИЬҪв¶ИІ»Н¬Ј¬ВИ»ҜДЖөДИЬҪв¶ИЛжЧЕОВ¶Иұд»ҜІ»ҙуЈ¬ЗвСх»ҜДЖИЬҪв¶ИҪПҙуЈ¬ЗТЛжОВ¶ИөДұд»ҜҪПҙ󣬹эВЛЦЖөГЗвСх»ҜДЖҫ§МеЈ¬№Кҙр°ёОӘЈә№эВЛЈ»NaOHЈ»
(5)ёщҫЭБчіМНјЈ¬ЙПКц№ӨТХЦРҝЙСӯ»·К№УГөДОпЦККЗNaClәНNaOHЈ¬№Кҙр°ёОӘЈәNaClәНNaOHЎЈ


 ФД¶БҝміөПөБРҙр°ё
ФД¶БҝміөПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝК№Т»ГҫВБәПҪр·ЫД©ФЪ№эБҝПЎH2SO4ЦРИЬҪвЈ¬ФЪЛщөГИЬТәЦРјУИлNaOHИЬТәЈ¬ЙъіЙіБөнөДЦКБҝwәНјУИлNaOHИЬТәөДМе»эVөД№ШПөИзНјЛщКҫЈ¬ФтёГәПҪрЦРГҫәНВБөДЦКБҝЦ®ұИОӘЈЁ Ј©
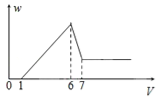
A. 2Јә3 B. 1Јә1 C. 4Јә3 D. 8Јә9
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪKNO3№ММеСщЖ·ЦРә¬УРЙЩБҝөДKClЎўBaCl2ФУЦКЈ¬ОӘБЛМбҙҝKNO3Іў·ЦАлөГөҪBaCl2Ј¬ҪшРРИзПВКөСйІЩЧчЈә
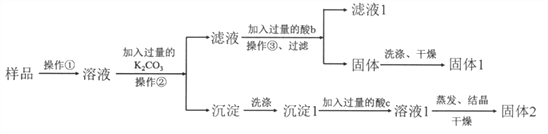
ЈЁ1Ј©јУИл№эБҝK2CO3Лщ·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ_________________________________Ј»
ЈЁ2Ј©ҪбәППВНјёчОпЦКөДИЬҪв¶ИЗъПЯҝЙЦӘІЩЧчўЫөДГыіЖКЗ_________________Ј»
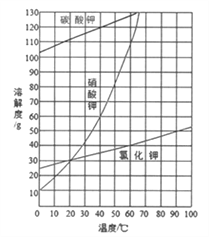
ЈЁ3Ј©УРИЛИПОӘІЩЧчўЫЦ®З°ОЮРијУИл№эБҝөДЛбbЈ¬ТІДЬөГөҪҙҝҫ»өД№ММе1Ј¬ДгИПОӘёГ№ЫөгКЗ·сХэИ·ЈҝІўЧціцҪвКН______________________________________ЎЈ
ЈЁ4Ј©УГЦЖөГөД KNO3№ММеЕдЦЖ 200 mL0.2mol/L KNO3 ИЬТәЎЈ
ўЩұҫКөСйУГөҪөДТЗЖчУРМмЖҪЎўТ©іЧЎўІЈБ§°фЎўЙХұӯЎўҪәН·өО№ЬЎўБҝНІЎў»№УР_______________Ј»
ўЪПВБРЗйҝц»бК№ЛщЕдЦЖөДKNO3 ИЬТәөДЕЁ¶ИЖ«ёЯөДКЗ______________ЈЁМоЧЦДёЈ©ЎЈ
AЈ®Г»УРПҙөУЙХұӯәНІЈБ§°ф BЈ®ИЭБҝЖҝІ»ёЙФпЈ¬ә¬УРЙЩБҝХфБуЛ®
CЈ®¶ЁИЭКұСцКУҝМ¶ИПЯ DЈ®¶ЁИЭКұё©КУҝМ¶ИПЯ
EЈ®¶ЁИЭәуИыЙПЖҝИы·ҙёҙТЎФИЈ¬ҫІЦГәуЈ¬ТәГжөНУЪҝМ¶ИПЯЈ¬ФЩјУЛ®ЦБҝМ¶ИПЯ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝCH3COOHКЗЦРС§»ҜС§ЦРіЈУГөДТ»ФӘИхЛбЈ¬Зл»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ЙијЖјтөҘКөСйЦӨГчCH3COOHОӘИхЛб__ЎЈ
ЈЁ2Ј©Пт0.1mol/L CH3COOHИЬТәЦРјУХфБуЛ®ПЎКНЦБ100mLЈ¬ФЪПЎКН№эіМЦРЈ¬ПВБРБҝөДұд»ҜКЗЈЁЎ°ФцҙуЎұЎўЎ°јхРЎЎұЎўЎ°І»ұдЎұ»тЎ°І»ДЬИ·¶ЁЎұЈ©Јә
n(H+)=___Ј¬![]() =___Ј¬
=___Ј¬![]() =__Ј¬c(OH-)=___ЎЈ
=__Ј¬c(OH-)=___ЎЈ
ЈЁ3Ј©OH-ЕЁ¶ИПаН¬өДөИМе»эөДБҪ·ЭИЬТәЈәСОЛбәНCH3COOHЈ¬·ЦұрУлРҝ·Ы·ҙУҰЈ¬ИфЧоәуҪцУРТ»·ЭИЬТәЦРҙжФЪРҝ·ЫЈ¬ЗТ·ЕіцЗвЖшөДЦКБҝПаН¬Ј¬ФтПВБРЛө·ЁХэИ·өДКЗ__ЈЁМоРҙРтәЕЈ©
ўЩ·ҙУҰРиТӘөДКұјдЈәCH3COOHЈҫHCl
ўЪҝӘКј·ҙУҰөДЛЩВКЈәHClЈҫCH3COOH
ўЫІОјУ·ҙУҰөДРҝ·ЫөДОпЦКөДБҝЈәCH3COOH=HCl
ўЬ·ҙУҰ№эіМөДЖҪҫщЛЩВКЈәCH3COOHЈҫHCl
ўЭСОЛбЦРУРРҝ·ЫКЈУа
ўЮCH3COOHИЬТәЦРУРРҝ·ЫКЈУа
ЈЁ4Ј©ПтұҘәНКіСОЛ®ЦРөОјУТ»¶ЁЕЁ¶ИөДСОЛбЈ¬¶ФіцПЦПЦПуөДФӨІвҝЙДЬХэИ·өДКЗ__ЎЈ
A.°ЧЙ«іБөн B.ТәМе·ЦІг C.ОЮГчПФПЦПу D.»ЖВМЙ«ЖшМе
ЈЁ5Ј©ПЦУРПВБРИЬТәЈәўЩҙҝЛ®Ј»ўЪpH=10өДNaOHИЬТәЈ»ўЫpH=3өДҙЧЛбИЬТәЈ»ўЬpH=10өДCH3COONaИЬТәЎЈКФұИҪПЛДЦЦИЬТәЦРЛ®өДөзАліМ¶ИөДҙуРЎ№ШПө__ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіхҘөДәПіЙВ·ПЯИзПВНјЛщКҫ

ЈЁ1Ј©·ҙУҰўс·ҙУҰАаРНОӘ___________________Ј» DЦРә¬Сх№ЩДЬНЕОӘ_____________РҙГыіЖЈ©ЎЈ
ЈЁ2Ј©·ҙУҰўтөД·ҙУҰМхјюОӘЈә_________________ЎЈ
ЈЁ3Ј©CЎъDөД»ҜС§·ҙУҰ·ҪіМКҪОӘ________________________________________ЎЈ
ЈЁ4Ј©РҙіцТ»ЦЦВъЧгПВБРМхјюөДEөДН¬·ЦТм№№МеөДҪб№№јтКҪОӘ__________________________ЎЈ
ўЩДЬ·ўЙъТшҫө·ҙУҰ ўЪә¬ұҪ»·ЗТұҪ»·ЙПТ»деҙъОпБҪЦЦ ўЫІ»ДЬУлДЖ·ҙУҰ
ЈЁ5Ј©РҙіцBәПіЙ![]() өДәПіЙВ·ПЯЎЈәПіЙВ·ПЯіЈУГөДұнКҫ·ҪКҪОӘЈә_______________
өДәПіЙВ·ПЯЎЈәПіЙВ·ПЯіЈУГөДұнКҫ·ҪКҪОӘЈә_______________
![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөЙПАыУГСх»ҜВБ»щ·ПҙЯ»ҜјБЈЁЦчТӘіЙ·ЦОӘAl2O3Ј¬»№ә¬УРЙЩБҝPd(оЩ)Ј©Ј©»ШКХБтЛбВБј°PdөДБчіМИзПВЈә

»ШҙрПВБРОКМвЈә
ЈЁ1Ј©Ҫ«БтЛбВБИЬТәХф·ўЕЁЛхәуЈ¬АдИҙөГөҪК®°ЛЛ®әПБтЛбВБ№ММеЈ¬ёГ№ММеөД»ҜС§КҪОӘ___ЎЈ
ЈЁ2Ј©ұәЙХКұAl2O3Ул(NH4)2SO4·ҙУҰөД»ҜС§·ҪіМКҪОӘ___ЎЈ
ЈЁ3Ј©НхЛ®КЗЕЁПхЛбәНЕЁСОЛб°ҙМе»эұИОӘ___өД»мәПОпЎЈНхЛ®І»ОИ¶ЁЈ¬јУИИКұДЬЙъіЙСЗПххЈВИ(NOCl)әНВИЖшЈ¬ёГ·ҙУҰөД»ҜС§·ҪіМКҪОӘ___ЎЈ
ЈЁ4Ј©ҪюТәYЦРә¬PdФӘЛШөДИЬЦККЗH2PdCl6(ВИоЩЛб)Ј¬ФтЎ°ЛбҪюЎұКұ·ҙУҰөД»ҜС§·ҪіМКҪОӘ___ЎЈ
ЈЁ5Ј©ИфЎ°ИИ»№ФӯЎұЦРөГөҪөД№ММеЦ»УРPdЈ¬ГҝЙъіЙ1molPdКұЙъіЙөДЖшМеөДОпЦКөДБҝОӘ___ЎЈ
ЈЁ6Ј©PdКЗУЕБјөДҙўЗвҪрКфЈ¬ЖдҙўЗвФӯАнОӘ2PdЈЁsЈ©+xH2ЈЁgЈ©ЁT2PdHxЈЁsЈ©Ј¬ЖдЦРxөДЧоҙуЦөОӘ0.8ЎЈТСЦӘЈәPdөДГЬ¶ИОӘ12gcm©Ғ3Ј¬Фт21.2cm3PdДЬҙўҙжұкЧјЧҙҝцПВH2өДЧоҙуМе»эОӘ___LЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЛ®ПөДЖАлЧУөзіШ°ІИ«РФДЬәГЎўјЫёсөНБ®Ўў¶Ф»·ҫіУСәГЈ¬УРЧЕҫЮҙуөДКРіЎЗ°ҫ°ЎЈДіДЖАлЧУөзіШ№ӨЧчФӯАнИзНјЈ¬өзіШЧЬ·ҙУҰОӘЈә2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3

ПВБРЛө·ЁҙнОуөДКЗ
A.ідөзКұЈ¬aҪУөзФҙХэј«
B.·ЕөзКұЈ¬ИЬТәЦРөДNa+ФЪNaFePO4Fөзј«ЙПөГөзЧУұ»»№Фӯ
C.ідөзКұЈ¬Тхј«ЙПөДөзј«·ҙУҰОӘNaTi2(PO4)3+2Na++2e©Ғ=Na3Ti2(PO4)3
D.АнВЫЙПЈ¬ёГөзіШФЪідөз»т·Еөз№эіМЦРИЬТәЦРөДc(Na+)І»ұд
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№эСх»ҜёЖКЗТ»ЦЦ°ЧЙ«№ММеЈ¬ОўИЬУЪАдЛ®Ј¬І»ИЬУЪТТҙјЈ¬»ҜС§РФЦКУл№эСх»ҜДЖАаЛЖЎЈДіС§П°РЎЧйЙијЖФЪјоРФ»·ҫіЦРАыУГCaCl2УлH2O2·ҙУҰЦЖИЎCaO2ЎӨ8H2OЈ¬Ч°ЦГИзНјЛщКҫЈә

»ШҙрПВБРОКМвЈә
ЈЁ1Ј©РЎЧйН¬С§ІйФДОДПЧөГЦӘЈәёГКөСйУГЦКБҝ·ЦКэОӘ20%өДH2O2ИЬТәЧоОӘККТЛЎЈКРКЫH2O2ИЬТәөДЦКБҝ·ЦКэОӘ30%ЎЈёГРЎЧйН¬С§УГКРКЫH2O2ИЬТәЕдЦЖФј20%өДH2O2ИЬТәөД№эіМЦРЈ¬К№УГөДІЈБ§ТЗЖчіэІЈБ§°фЎўҪәН·өО№ЬНвЈ¬»№УР___ЎЈ
ЈЁ2Ј©ТЗЖчXөДЦчТӘЧчУГіэөјЖшНвЈ¬»№ҫЯУРөДЧчУГКЗ___ЎЈ
ЈЁ3Ј©ФЪұщЛ®ФЎЦРҪшРРөДФӯТтКЗ___ЎЈ
ЈЁ4Ј©КөСйКұЈ¬ФЪИэҫұЙХЖҝЦРОціцCaO2ЎӨ8H2Oҫ§МеЈ¬ЧЬ·ҙУҰөДАлЧУ·ҪіМКҪОӘ___ЎЈ
ЈЁ5Ј©·ҙУҰҪбКшәуЈ¬ҫӯ№эВЛЎўПҙөУЎўөНОВәжёЙ»сөГCaO2ЎӨ8H2OЎЈПВБРКФјБЦРЈ¬ПҙөУCaO2ЎӨ8H2OөДЧојССЎФсКЗ____ЎЈ
AЈ®ОЮЛ®ТТҙј BЈ®ЕЁСОЛб CЈ®Na2SO3ИЬТә DЈ®CaCl2ИЬТә
ЈЁ6Ј©ИфCaCl2ФӯБПЦРә¬УРFe3+ФУЦКЈ¬Fe3+ҙЯ»Ҝ·ЦҪвH2O2Ј¬»бК№H2O2өДАыУГВКГчПФҪөөНЎЈ·ҙУҰөД»ъАнОӘЈә
ўЩFe3+ +H2O2=Fe2++H++HOOЎӨ
ўЪH2O2+X=Y +Z+WЈЁТСЕдЖҪЈ©
ўЫFe2++ЎӨOH=Fe3++OH-
ўЬH+ +OH-=H2O
ёщҫЭЙПКц»ъАнНЖөјІҪЦиўЪЦРөД»ҜС§·ҪіМКҪОӘ___ЎЈ
ЈЁ7Ј©№эСх»ҜёЖҝЙУГУЪіӨНҫФЛКдУгГзЈ¬ХвМеПЦБЛ№эСх»ҜёЖҫЯУР____өДРФЦКЎЈ
A.УлЛ®»әВэ·ҙУҰ№©Сх B.ДЬОьКХУгГзәфіцөДCO2ЖшМе
C.ДЬКЗЛ®МеЛбРФФцЗҝ D.ҫЯУРЗҝСх»ҜРФЈ¬ҝЙЙұҫъГрФе
ЈЁ8Ј©Ҫ«ЛщөГCaO2ЎӨ8H2Oҫ§МејУИИөҪ150~160ЎжЈ¬НкИ«НСЛ®әуөГөҪ№эСх»ҜёЖСщЖ·ЎЈ
ёГРЎЧйІв¶Ё№эСх»ҜёЖСщЖ·ЦРCaO2өДҙҝ¶ИөД·Ҫ·ЁКЗЈәЧјИ·іЖИЎ0.4000g№эСх»ҜёЖСщЖ·Ј¬400ЎжТФЙПјУИИЦБНкИ«·ЦҪвіЙCaOәНO2(ЙиФУЦКІ»ІъЙъЖшМе)Ј¬өГөҪ33.60mL(ТС»»ЛгОӘұкЧјЧҙҝц)ЖшМеЎЈ
ФтЈәЛщөГ№эСх»ҜёЖСщЖ·ЦРCaO2өДҙҝ¶ИОӘ_____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»мәПОпөДЛ®ИЬТәЦРЈ¬Ц»ҝЙДЬә¬УРТФПВАлЧУЦРөДИфёЙЦЦЈәKЈ«ЎўMg2Ј«ЎўFe3Ј«ЎўNH![]() ЎўClЈӯЎўCO
ЎўClЈӯЎўCO![]() әНSO
әНSO![]() ЎЈПЦГҝҙОИЎ10.00 mLҪшРРКөСйЈә
ЎЈПЦГҝҙОИЎ10.00 mLҪшРРКөСйЈә
ўЩөЪТ»·ЭјУИлAgNO3ИЬТәУРіБөнІъЙъЈ»
ўЪөЪ¶ю·ЭјУИлЧгБҝNaOHәујУИИЈ¬КХјҜөҪЖшМе0.672 LЎЎ(ұкЧјЧҙҝцПВ)Ј»
ўЫөЪИэ·ЭјУЧгБҝBaCl2ИЬТәәуөГёЙФпіБөн6.63 gЈ¬іБөнҫӯЧгБҝСОЛбПҙөУЈ¬ёЙФпәуКЈ4.66 gЎЈ
Зл»ШҙрЈә
(1) c(CO![]() )ЈҪ____molЎӨLЈӯ1ЎЈ
)ЈҪ____molЎӨLЈӯ1ЎЈ
(2) KЈ«КЗ·сҙжФЪЈҝ_______Ј»ИфҙжФЪЈ¬ЕЁ¶И·¶О§КЗ_____(ИфІ»ҙжФЪЈ¬ФтІ»ұШ»Шҙр)ЎЈ
(3) ёщҫЭТФЙПКөСй:
ўЩІ»ДЬЕР¶ПДДР©АлЧУКЗ·сҙжФЪ________________;
ўЪИфҙжФЪХвР©АлЧУЈ¬ИзәОҪшРРјмСйЈҝ_____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com