
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
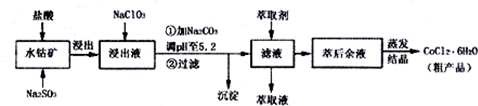
分析 含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品,
(1)亚硫酸钠具有还原性,能还原氧化性离子;
(2)NaClO3具有氧化性,能氧化亚铁离子生成铁离子;
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3沉淀;
(4)由表中数据可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
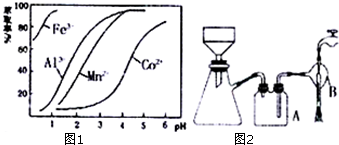
(5)①分液漏斗检漏,主要是检查玻璃塞和旋塞芯是否漏水,若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好;
②根据装置图可知仪器名称,抽滤时要蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上,然后要开大水龙头,待溶液快流尽时再转移沉淀,当液面高度接近支管口位置时,滤液要从上口倒出,洗涤时抽滤速率不能太快,抽滤操作不宜用于过滤胶状或颗粒太小的沉淀,根据洗涤滤液中是否含有杂质离子判断晶体是否洗涤干净,本实验中可以通过焰色反应判断.
解答 解:含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品,
(1)亚硫酸根离子具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,
故答案为:将Fe3+、Co3+还原;
(2)NaClO3具有氧化性,能氧化亚铁离子生成铁离子,氯酸根离子被还原生成氯离子,离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)NaClO3的作用是将Fe2+氧化成Fe3+,加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以加Na2C03调pH至5.2的目的是完全沉淀Fe3+、Al3+,
故答案为:完全沉淀Fe3+、Al3+;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故选C;
(5)①分液漏斗检漏,主要是检查玻璃塞和旋塞芯是否漏水,若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好,
故答案为:玻璃塞;旋塞芯;若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好;
②根据装置图可知仪器A的名称是安全瓶,B的名称是抽气泵,抽滤时要蒸馏水润湿滤纸,微开水龙头,故A正确,抽气使滤纸紧贴在漏斗瓷板上,然后要开大水龙头,故B正确,待溶液快流尽时再转移沉淀,当液面高度接近支管口位置时,滤液要从上口倒出,故C错误,洗涤时抽滤速率不能太快,故D错误,抽滤操作不宜用于过滤胶状或颗粒太小的沉淀,故E正确,故选ABE,判断晶体是否洗涤干净的方法是用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净,
故答案为:安全瓶;抽气泵;ABE;用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净.
点评 本题考查物质的分离和提纯,侧重考查学生分析判断能力,涉及氧化还原反应、离子反应、pH与沉淀的关系等知识点,为高频考点,明确流程图中发生的反应及基本操作是解本题关键,熟悉常见化合物的性质,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{{H}_{2}S{O}_{4}}{→}$CuSO4$\stackrel{Ba(N{O}_{3})_{2}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{{H}_{2}O}{→}$Cu(OH)2$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀时的pH | 9.0 | 3.2 | 4.7 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀. | 得黄棕色溶液 | |
| 取少量溶液于试管中,滴加溶液 ①0.05mol/L酸性高锰酸钾; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③产生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使溶液的pH增加 | |
| B. | 都能使溶液的导电性增强 | |
| C. | 溶液中c(H+)•c(OH-)增大 | |
| D. | 都能使溶液中$\frac{c(CHCO{O}^{-})}{c(CHCOO{H}^{+})}$比值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给烧杯中的液体加热时,不需垫石棉网 | |
| B. | 用药匙或者纸槽把粉末状药品送人试管的底部 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 给试管中的液体加热时管口不要对着白己和别人,以免液体暴沸伤人 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com