
| A. | X、Z、W均可形成两种常见氧化物 | |
| B. | 四种元素在自然界均不能以游离态存在 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
分析 X元素的原子的最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,L为最外层电子数为4,则X是C元素;Y是非金属性最强的元素,则Y为F元素;Z原子半径在同周期元素中最大,其原子序数大于C、F元素,则Z为Na;W可与Z形成离子化合物Z2W,即Na2W,W为-2价,原子序数大于Na,则W为S元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:X元素的原子的最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,L为最外层电子数为4,则X是C元素;Y是非金属性最强的元素,则Y为F元素;Z原子半径在同周期元素中最大,其原子序数大于C、F元素,则Z为Na;W可与Z形成离子化合物Z2W,即Na2W,W为-2价,原子序数大于Na,则W为S元素,
A.C、Na、S分别可形成CO和二氧化碳、氧化钠和过氧化钠、二氧化硫和三氧化硫,故A正确;
B.Na、F在自然界中以化合态存在,但C和S在自然界中存在游离态,故B错误;
C.Y为F元素,位于ⅤⅡA族,F的最高化合价为0,不是+7,故C错误;
D.离子的电子层越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则离子半径:W>Y>Z,故D错误;
故选:A.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na2C2O4溶液中,2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等体积等物质的量浓度的NaCl和NaClO溶液,两份溶液中离子总数相比前者大 | |
| D. | 0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
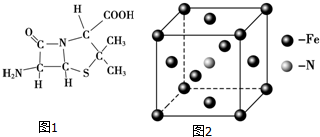
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
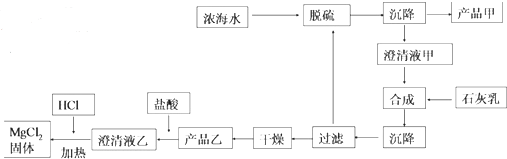
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金 | B. | 硫 | C. | 铜 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
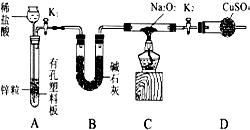
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经气化或液化这两个化学变化过程都可以转变为清洁能源 | |
| B. | 石油裂解目的是提高汽油的质量和产量 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com