
| A. | 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管 | |
| C. | Ni-Zn化合物的纳米颗粒可作 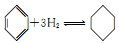 反应的催化剂,提高苯的转化率 反应的催化剂,提高苯的转化率 | |
| D. | 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用 |
分析 A.铁粉具有还原性;
B.晶体管材料应具有导电性;
C.催化剂对平衡无影响;
D.K2FeO4具有强氧化性,且还原产物铁离子可水解生成胶体.
解答 解:A.活性铁粉具有还原性,富脂食品包装时,放入活性铁粉等抗氧剂,以防止油脂氧化变质,故A正确;
B.晶体管材料应具有导电性,锗电子迁移率比硅强,可用于半导体材料,故B正确;
C.催化剂能增大反应速率,但是对平衡无影响,所以转化率不变,故C错误;
D.K2FeO4具有强氧化性,且还原产物铁离子可水解生成胶体,则用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | ④②①③ | B. | ④③①② | C. | ④③②① | D. | ①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH与C2H518OH在浓硫酸作用下加热,反应生成的有机物分子的结构简式为CH3COOC2H5 | |
| B. | 可以用饱和碳酸钠溶液鉴别乙醇、乙酸、苯和四氯化碳 | |
| C. | 有机物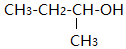 的名称为1-甲基-1-丙醇 的名称为1-甲基-1-丙醇 | |
| D. | 向淀粉溶液中加入少量稀硫酸后煮沸几分钟,冷却后加入银氨溶液,水浴加热一段时间没有银镜产生,说明淀粉仍未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能够使溴水褪色,是因为乙烯和溴水反应生成了2-溴乙烷 | |
| B. | 将红热的铜丝插入到1-丙醇中,可以制得丙酮 | |
| C. | 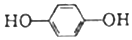 和苯酚互为同系物 和苯酚互为同系物 | |
| D. | 分子式为C10H12具有两个邻位链烃取代基的芳香烃有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g 分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | Na2O2与H2O的反应中每生成0.1molO2,转移电子数目为0.4NA | |
| C. | 常温常压下,1.7g NH3所含电子数为0.8NA | |
| D. | 标准状况下,11.2L NO与11.2LO2混合,原子总数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1所示的装置可用于干燥、收集并吸收多余的氨气 | |
| B. | 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 | |
| C. | 图3所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| D. | 图4所示装置用于除去碳酸氢钠固体中的少量碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
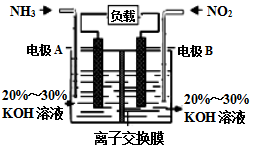 2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.物质 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com