
| A. | pH=1的溶液:Na+、NH4+、S2-、NO3- | |
| B. | c(HSO4-)=0.1 mol/L的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 滴入少量苯酚显紫色的溶液:Na+、K+、I-、SO42- | |
| D. | 能溶解碳酸钙的溶液:Na+、NH4+、Cl-、Br- |
分析 A.酸性条件下离子之间发生氧化还原反应;
B.c(HSO4-)=0.1 mol/L的溶液呈酸性,且含有SO42-;
C.滴入少量苯酚显紫色的溶液含有Fe3+;
D.能溶解碳酸钙的溶液呈酸性.
解答 解:A.pH=1的溶液呈酸性,S2-、NO3-之间发生氧化还原反应,故A错误;
B.c(HSO4-)=0.1 mol/L的溶液呈酸性,且含有SO42-,Ba2+、HCO3-不能大量共存,故B错误;
C.滴入少量苯酚显紫色的溶液含有Fe3+,I-不能大量共存,故C错误;
D.能溶解碳酸钙的溶液呈酸性,酸性条件下离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存问题,为高频考点,侧重学生的分析能力的考查,题目难度中等,本题注意把握相关题给信息,为解答该类题目的关键,学习中注重相关基础知识的积累.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:Na+、K+、AlO2-、CO32- | |
| B. | 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+ | |
| C. | pH=7的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | c(OH-)=1×10-13 mol/L的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
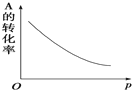 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO制备HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKp | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 催化剂通过降低化学反应的焓变加快化学反应速率 | |
| B. | 反应N2(g)+3H2(g)═2NH3(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s)低温下能自发进行,说明该反应的△H<0 | |
| D. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗盐酸的体积更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
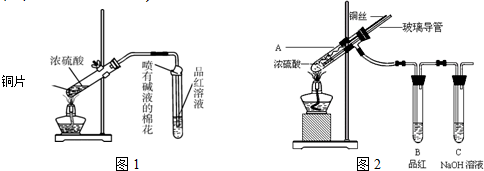
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com