
| A. | 只有② | B. | ②④ | C. | ③④ | D. | ①②③ |
分析 根据Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O、Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O、3NO2+H2O═2HNO3+NO来解答.
解答 解:根据Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O、Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O、3NO2+H2O═2HNO3+NO
①等量的Fe与酸反应,浓硝酸消耗的多,故①错误;
②等量的Fe与酸反应,由Fe原子守恒可知生成Fe(NO3)3的物质的量相同,故②正确;
③等量的Fe与酸反应,浓硝酸反应生成气体多,故③错误;
④因3NO2+H2O═2HNO3+NO,最终收集气体均为NO,由电子守恒可知,收集NO的体积相等,故④正确;
故选B.
点评 本题考查Fe与硝酸的反应,为高频考点,把握浓度不同发生的反应不同及发生的化学反应方程式为解答的关系,题目难度不大.


科目:高中化学 来源: 题型:实验题
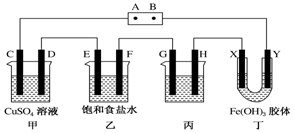
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA | |
| C. | 室温下,2L0.05mol/L 的NH4NO3溶液中所含有的氮原子数目是0.2NA | |
| D. | 22.4L Cl2 与足量NaOH溶液反应时转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能是第二周期的元素 | B. | a一定比b小 | ||
| C. | b-a+m+n一定等于16 | D. | Y只能是第三周期的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
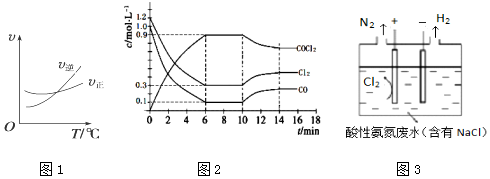
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(a+$\frac{b}{2}$+c)kJ/mol | B. | +(a+$\frac{b}{2}$+c)kJ/mol | C. | -(2a+b+2c)kJ/mol | D. | +(2a+b+2c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中肯定不含非极性共价键 | B. | 原子晶体的熔点肯定高于其他晶体 | ||
| C. | 由分子组成的物质其熔点一定较低 | D. | 构成晶体的粒子一定含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com