
| A. | 4△H3-6△H1-4△H2 | B. | 6△H1+4△H2-4△H3 | C. | △H1+△H2-△H3 | D. | △H3-△H1-△H2 |
分析 已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
根据盖斯定律,①×6-③×4+②×4可得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g),反应焓变也进行相应的计算.
解答 解:由①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
根据盖斯定律,①×6-③×4+②×4可得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g),故反应焓变△H=6△H1+4△H2-4△H3,故选B.
点评 本题考查根据盖斯定律进行反应热的计算,难度不大,关键是由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式.


科目:高中化学 来源: 题型:选择题
 、⑥
、⑥ 、⑦
、⑦ 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬ .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )| A. | ⑤⑥⑦ | B. | ④⑨⑩ | C. | ⑪⑫⑬ | D. | ①②③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN的水溶液显碱性 | |
| B. | 1mol/L氢氰酸溶液的pH约为5 | |
| C. | 10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比盐酸溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述反应中,只有一种元素被氧化 | |
| B. | 反应生成1molN2时,电子转移6mol | |
| C. | 还原产物与氧化产物的物质的量之比为1:3 | |
| D. | 在反应中高氯酸铵既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,B的结构式为
,B的结构式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
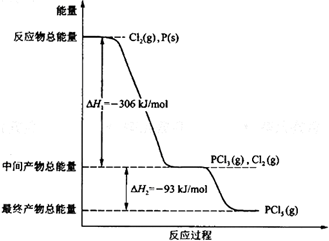 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com