
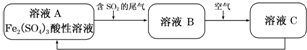
| A. | 向B溶液中滴加KSCN溶液,溶液不会变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液B |
分析 A.尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生氧化还原反应,三价铁离子氧化二氧化硫为硫酸,本身被还原,B溶液含有二价铁离子,二价铁离子与KSCN溶液不反应;
B.根据氧化性O2>Fe3+角度进行分析解答,该离子方程式左右电荷不守恒;
C.溶液A为Fe2(SO4)3溶液中三价铁离子水解显酸性,溶液B为硫酸溶液,显酸性,溶液C为硫酸铁溶液和硫酸溶液,据此分析解答;
D.溶液C为硫酸铁溶液和硫酸溶液,加氧化亚铁可以使硫酸转化为硫酸亚铁.
解答 解:A.尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生2Fe3++2H2O+SO2=2Fe2++SO42-+4H+,B溶液中存在二价铁离子,二价铁离子与KSCN溶液不反应,溶液不会变为血红色,故A正确;
B.溶液B中发生的反应是亚铁离子被氧气氧化为三价铁离子的反应:4Fe2++O2+4H+=4Fe3++2H2O,故B错误;
C.反应过程中溶液的体积不变,溶液A为Fe2(SO4)3溶液中三价铁离子水解显酸性,溶液B为被二氧化硫还原生成的硫酸亚铁和二氧化硫被氧化生成的硫酸溶液,显酸性,溶液C为硫酸铁溶液和硫酸溶液,是发生反应4Fe2++O2+4H+=4Fe3++2H2O的结果,虽然消耗氢离子但溶液呈酸性,B>C>A,故C错误;
D.溶液C为硫酸铁溶液和硫酸溶液,加氧化亚铁,氧化亚铁和硫酸反应生成硫酸亚铁、水,溶液C为硫酸铁溶液和硫酸亚铁溶液,故D错误;
故选A.
点评 本题考查了污染气体二氧化硫的综合处理工艺流程的分析判断,为高频考点,侧重于学生的分析能力的考查,题目涉及氧化还原反应的规律应用,主要是考查二氧化硫的还原性、三价铁离子的氧化性、二价铁离子的还原性的性质应用,注意反应的产物判断是本题的关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大单位体积内分子的总数,从而成千上万倍地增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
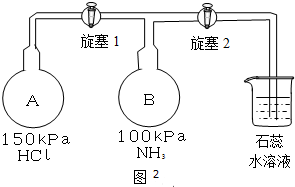
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为还原反应 | |
| B. | 上述反应中若产生0.1mol SO42-,则消耗SO2的物质的量为0.1mol | |
| C. | Fe2(SO4)3、品红两种溶液都能使上述反应进行 | |
| D. | 通入Cl2会增强SO2的漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用10ml量筒量取7.5ml稀盐酸 | |
| B. | 用托盘天平称取25.20gNaCl晶体 | |
| C. | 用蒸发结晶的方法由硫酸铜溶液制取蓝帆 | |
| D. | 用100ml容量瓶配置0.5mol/l的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com