
| A. | 氮气的电子式: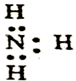 | B. | N2的结构式:N≡N | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | CH4分子的球棍模型: |
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2H+-2e-═H2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
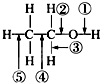 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 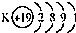 钾原子结构示意图 钾原子结构示意图 | |
| B. |  水合钠离子示意图 | |
| C. | 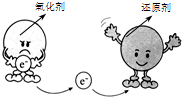 氧化还原反应与电子转移关系示意图 氧化还原反应与电子转移关系示意图 | |
| D. | 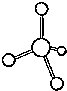 CH4分子示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过足量的NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的酸性KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com