



科目:高中化学 来源: 题型:
| A、澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| B、碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、盛装氢氧化钠溶液的试剂瓶不可以用玻璃塞:SiO2+2Na++2 OH-=Na2SiO3+H2O |
| D、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
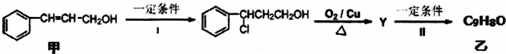
| Ⅰ.O3 |
| ⅡZn/H2O |
| Ⅰ.浓NaOH |
| Ⅱ.H+ |
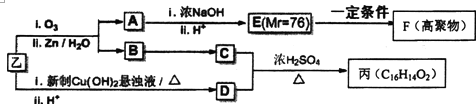
查看答案和解析>>
科目:高中化学 来源: 题型:
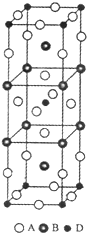 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.查看答案和解析>>
科目:高中化学 来源: 题型:
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1个 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、0.1mol?L-1 Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| C、0.1mol?L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| D、向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
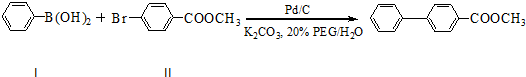

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com