
【题目】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两对未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对的电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号________,该能层具有的原子轨道数为_________。
(2)E2+离子的价层电子排布图是__________,F原子的电子排布式是__________。
(3)A元素的最高价氧化物对应的水化物中心原子采用的轨道杂化方式为______,B元素的气态氢化物的VSEPR模型为___________。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为_____________
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为________________________
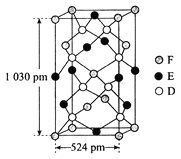
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,其化学式为_____。
【答案】 M 9 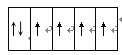 〔Ar〕3d104s1 sp2 四面体形
〔Ar〕3d104s1 sp2 四面体形 ![]() 3Fe2+ + 2〔Fe(CN)6〕3- = Fe3〔Fe(CN)6〕2↓ CuFeS2
3Fe2+ + 2〔Fe(CN)6〕3- = Fe3〔Fe(CN)6〕2↓ CuFeS2
【解析】A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素。
(1)基态S原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9 个原子轨道,故答案为:M;9;
(2)Fe2+离子的价层电子排布3d6,其价层电子排布图是![]() ,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,故答案为:
,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,故答案为:![]() ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;
(3)碳元素的最高价氧化物对应的水化物为H2CO3,分子结构式为![]() ,中心C原子成3个σ键、没有孤电子对,C原子采取sp2杂化方式;B的气态氢化物为NH3,VSEPR模型为四面体,故答案为:sp2;四面体;
,中心C原子成3个σ键、没有孤电子对,C原子采取sp2杂化方式;B的气态氢化物为NH3,VSEPR模型为四面体,故答案为:sp2;四面体;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,它们结构相似,SCN-中C原子与S、N原子之间形成2对共用电子对,SCN-的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)配合物甲的焰色反应呈紫色,含有K元素,其内界由中心离子Fe3+与配位体CN-构成,配位数为6,甲为K3[Fe(CN)6],甲的水溶液可以用于实验室中Fe2+离子的定性检验,检验Fe2+离子的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(6)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×![]() +4×
+4×![]() =4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×
=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×![]() +1+8×
+1+8×![]() =4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,故答案为:CuFeS2。
=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,故答案为:CuFeS2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将铁、铜通过导线相连,置于稀硫酸中. 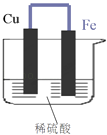
(1)铁片为极,其电极反应式 .
(2)铜片上的现象是 , 其发生的反应的类型是反应.(填“氧化”或“还原”)
(3)若导线中通过了0.6mol电子,Fe的质量理论上减少克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( ) 
A.Y的非金属性比Z的弱
B.三种元素均为非金属元素
C.Z形成的气态氢化物比Y形成的气态氢化物稳定
D.Y元素的最高正化合价比Z元素的最高正化合价高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下混合下列气体,所得混合气体平均摩尔质量为36 g.mol -1 ,它们可能是
A. NO2 和NO B. CO和CH4 C. N2 和O2 D. O2 和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对于反应N2(g)+3H2(g) ![]() 2NH3(g)△H=-92.4 kJ·mol-1。N2的平衡转化率(
2NH3(g)△H=-92.4 kJ·mol-1。N2的平衡转化率(![]() )与体系总压强(P)的关系如右图所示。下列说法正确的是( )
)与体系总压强(P)的关系如右图所示。下列说法正确的是( )
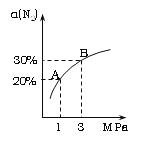
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) < K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2和SO2都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl2、SO2混合再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①② B.①③
C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D 4种短周期元素,它们的元素原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构.B原子的最外层电子数是次外层的三倍,C、D单质都能跟水剧烈反应,1mol D单质跟水反应产生11.2L(标准状况)A气体,此时D转化为具有氖原子核外电子层结构的离子.试填写:
(1)用电子式表示A和C形成化合物的过程 .
(2)C原子的结构示意图 , 写出A、B两元素按1:1原子个数比形成化合物的电子式 .
(3)这4种元素的原子半径由大到小的顺序为 . (用元素符号表示)
(4)写出C单质与水反应的化学反应方程式;.
(5)写出D单质与水反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mL
B.45mL
C.30mL
D.15mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com