
分析 (1)电解硫酸铜和氯化钠混合溶液时,阴极上铜离子先放电,然后氢离子放电,阳极上氯离子先放电,然后氢氧根离子放电,若在一个电极上得到0.01mol Cu,根据转移电子守恒判断另一电极上生成气体成分及生成气体的物质的量,再根据m=nM计算生成气体质量;
(2)根据氧气和氢离子之间的关系式计算氢离子的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:(1)电解硫酸铜和氯化钠混合溶液时,阴极上铜离子先放电,然后氢离子放电,阳极上氯离子先放电,然后氢氧根离子放电,若在一个电极上得到0.01mol Cu,转移电子的物质的量=0.01mol×2=0.02mol,
阳极上0.01mol氯离子放电转移电子的物质的量=0.01mol×1=0.01mol<0.02mol,所以阳极上还有氢氧根离子放电,转移0.01mol电子生成氧气的物质的量=$\frac{0.01mol}{4}$=0.0025mol,所以生成氯气的质量=$\frac{0.01}{2}$×71=0.355g,生成氧气的质量为0.0025×32=0.08g,故答案为:既有0.355gCl2又有0.08gO2;
(2)阳极上氢氧根离子放电时生成氢离子,实际上是电解硫酸铜溶液,2H2O+2Cu$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,
根据(1)知,生成氧气的物质的量0.0025mol,根据氧气和氢离子之间的关系式得n(H+)=4n(O2)
=0.01mol,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,所以pH减小,
故答案为:减小;0.1mol/L;
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子守恒确定阳极上放电的离子,根据物质之间的关系式来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
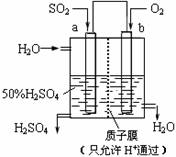
| A. | a为正极,b为负极 | |
| B. | 生产过程中a电极质量减轻 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的电子式为
E的电子式为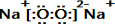 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放待测液的锥形瓶使用前未用待测液润洗 | |
| B. | 用酚酞作指示剂,配制好的碱溶液在空气中吸收了少量二氧化碳气体 | |
| C. | 锥形瓶中颜色由红色变无色,马上记录终点读数,但半分钟不到,溶液又恢复红色 | |
| D. | 读标准酸液初始体积时俯视,终点时平视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2是还原产物,CO2是氧化产物 | |
| B. | 每生成22.4LCO2需转移3 mol电子 | |
| C. | 反应中氧化剂和还原剂的物质的量之比为4:3 | |
| D. | N元素既被氧化,也被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10L | B. | 15L | C. | 25L | D. | 27L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com