
分析 (1)混合物中碳酸钠的质量分数=$\frac{碳酸钠的质量}{样品质量}$×100%,混合物的质量为mg,碳酸钠的质量可根据碳酸钡的质量ng来求出;氯化钙溶液过量,则生成微溶的氢氧化钙,沉淀中含有Ca(OH)2;
(2)滴定过程中所需要的主要玻璃仪器有酸式滴定管、锥形瓶;开始溶液呈碱性酚酞呈红色,当滴定终点时溶液呈中性呈无色,加入过量氯化钡溶液的目的是使碳酸钠完全转化,氯化钡过量的方法是取上层清夜少许向其中滴加氯化钡溶液,若无浑浊出现,则氯化钡溶液过量.
解答 解:(1)设碳酸钠的质量为x
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x ng
x=$\frac{106×ng}{197}$=$\frac{106n}{197}$g,
混合物中碳酸钠的质量分数为:$\frac{\frac{106n}{197}}{m}$×100%=$\frac{106n}{197m}$,氯化钙溶液过量,则生成微溶的氢氧化钙,沉淀中含有Ca(OH)2;
故答案为:$\frac{106n}{197m}$;否;氯化钙溶液过量,则生成的沉淀中含有Ca(OH)2,使测定不准确;
(2)滴定过程中所需要的主要玻璃仪器有酸式滴定管、锥形瓶;开始溶液呈碱性酚酞呈红色,当滴定终点时溶液呈中性呈无色,加入过量氯化钡溶液的目的是使碳酸钠完全转化,氯化钡过量的方法是取上层清液少许向其中滴加氯化钡溶液,若无浑浊出现,则氯化钡溶液过量,故答案为:酸式滴定管、锥形瓶;溶液由红色变为无色;将碳酸钠完全沉淀,防止滴定过程中CO32-和盐酸反应;在上层清夜中滴加氯化钡溶液,若无浑浊出现,则氯化钡溶液过量.
点评 本题考查了碳酸钠的性质、化学实验方案的设计与评价,题目难度中等,明确实验方案的设计与评价方法,试题有利于提高学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇苯酚显紫色的溶液:Na+、Al3+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液:K+、Mg2+、SO42-、NO3- | |
| C. | 加入淀粉碘化钾溶液变蓝色的溶液:Na+、CO32-、HSO3-、OH- | |
| D. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
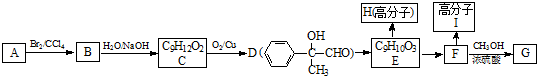
 .
. ;②F→G
;②F→G .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化铜溶液的阳极反应式为2Cl--2e-═Cl2↑ | |
| B. | 燃料电池负极加入或通入的物质是助燃物 | |
| C. | 原电池中电子从负极经过溶液流入正极 | |
| D. | 用惰性电极电解硝酸银溶液,一段时间后,溶液酸性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com