
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
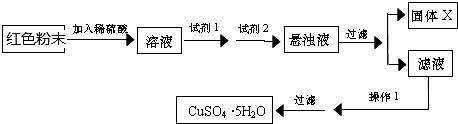
分析 (1)若假设1成立,固体完全是Fe2O3,则少量粉末放入足量稀硫酸中,在反应后的溶液中含有Fe3+,在所得溶液中再滴加 KSCN 试剂,观察到的实验现象是溶液变为血红色;
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应,故此种说法不正确;
(3)若固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu;
(4)实验小组欲用加热法测定Fe2O3和Cu2O的混合物中Cu2O质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,发生反应:2Cu2O+O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuO,称其质量为bg(b>a),增加质量是氧气的质量,m(O2)=(b-a)g,根据方程式可知m(Cu2O):m(O2)=288:32,m(O2)=(b-a)g,则m(Cu2O)=(288:32)×(b-a)g=9(b-a)g,得到在原混合物中Cu2O的质量分数;
(5)用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4?5H2O),先加稀硫酸溶解金属氧化物,然后向溶液中加入H2O2,将溶液中的Fe2+氧化形成Fe3+,再向溶液中加入Cu2(OH)2CO3,消耗H+,调节溶液的pH,使溶液中的杂质Fe3+形成Fe(OH)3沉淀,将其过滤除去,得到CuSO4溶液,将滤液蒸发浓缩、冷却结晶,再过滤,就得到CuSO4?5H2O.①试剂I为H2O2;试剂II为Cu2(OH)2CO3,代号分别是B、F②固体X的化学式为Fe(OH)3.
解答 解:(1)若假设1成立,固体完全是Fe2O3,则少量粉末放入足量稀硫酸中,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,在反应后的溶液中含有Fe3+,在所得溶液中再滴加 KSCN 试剂,观察到的实验现象是溶液变为血红色
故答案为:溶液变为血红色;
(2)若滴加 KSCN 试剂后溶液不变红色,则说明反应后的溶液中无Fe3+,可能是原固体粉末中不含三氧化二铁.也可能是Fe2O3,同时含有Cu2O,Fe2O3与硫酸发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Cu2O与硫酸发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O,反应产生的Cu与Fe2(SO4)3发生反应:Cu+Fe2(SO4)3=CuSO4+2FeSO4,因此说法不合理.
故答案为:不合理;
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O,发生反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O; Cu2O+2H+=Cu+Cu2++H2O; 2Fe3++Cu=2Fe2++Cu2+;
故答案为:Fe2O3和Cu2O的混合物;Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2 Fe3++Cu=2 Fe2++Cu2+;
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
设样品中氧化亚铜的质量为m,
2Cu2O+O2═4CuO△m
288g 32g
m (b-a)g
m=$\frac{288g(b-a)g}{32g}$=9(b-a)g,
混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}×100%$,
故答案为:$\frac{9(b-a)}{a}×100%$;
(5)用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4?5H2O),先加稀硫酸溶解金属氧化物,然后向溶液中加入H2O2,将溶液中的Fe2+氧化形成Fe3+,再向溶液中加入Cu2(OH)2CO3,消耗H+,调节溶液的pH,使溶液中的杂质Fe3+形成Fe(OH)3沉淀,将其过滤除去,得到CuSO4溶液,将滤液蒸发浓缩、冷却结晶,再过滤,就得到CuSO4?5H2O.①试剂I为H2O2;试剂II为Cu2(OH)2CO3,代号分别是B、F②固体X的化学式为Fe(OH)3,
故答案为:B;F;Fe(OH)3.
点评 本题考查三氧化二铁和氧化亚铜的性质及应用的知识,考查实验的设计及评价,以及物质的组成及含量的测定,本题难度较大,做题时注意把握题给信息.


科目:高中化学 来源: 题型:解答题
 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚2-甲基-1-丙烯可以通过加聚反应制得 | |
| B. | 聚2-甲基-1-丙烯的分子式为 (C4H8)n | |
| C. | 聚2-甲基-1-丙烯完全燃烧生成CO2和H2O的物质的量相等 | |
| D. | 聚2-甲基-1-丙烯能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是强电解质,BaCO3是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.1 mol•L-1醋酸溶液加水稀释时,电离能力增强,但c(H+)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中不存在独立的“分子” | |
| B. | 含有1 mol C的金刚石中,形成的共价键有2 mol | |
| C. | 是自然界中硬度最大的物质 | |
| D. | 化学性质稳定,即使在高温下也不会与氧气发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com