
| A. | 冰融化成水 | B. | 氯气溶于水 | C. | 氯化钠熔化 | D. | 酒精溶于水 |
科目:高中化学 来源: 题型:选择题
| A. | $\frac{106(m-n)}{11m}$×100% | B. | $\frac{168(m-n)}{56m}$×100% | C. | $\frac{84(n-m)?}{11m}$×100% | D. | $\frac{?(n-m)?}{m}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb 为负极,发生还原反应 | |
| B. | 放电过程,正负极质量均增重 | |
| C. | 导线中每通过 1mole-,溶液中减少 2molH+ | |
| D. | 电子由 Pb 经外电路流向 PbO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
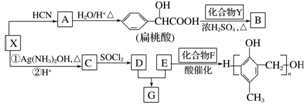
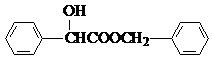 .
.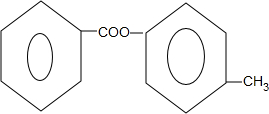 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$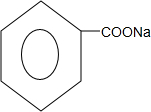 +
+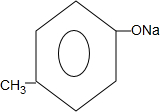 +H2O.
+H2O.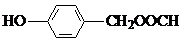 ,
,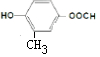 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化锂是一种电解质 | B. | LiH是离子晶体[ | ||
| C. | LiH是一种强氧化剂 | D. | LiH中Li+半径小于H-半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 30 | 60 | 100 | 120 |
| 沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
| A.混合前,BaCl2溶液的物质的量浓度为0.10mol•L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15mol•L-1 |
| C.3号实验中沉淀的质量x为1.398g |
| D.完全沉淀60mL Na2SO4溶液消耗BaCl2溶液的体积为80mL |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
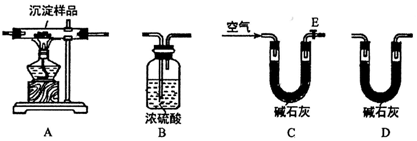
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com