
| (1)不同晶体熔沸点比较.
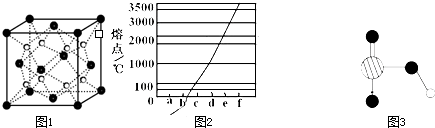
原子晶体要熔化,需破坏原子之间的共价键,离子晶体要熔化,需破坏离子键,而分子晶体熔化时只需克服分子之间的范德华力,由于键能要比范德华力大得多,所以一般来说,三种晶体熔沸点顺序为:原子晶体>离子晶体>分子晶体.但是这一规律不能绝对化,如“原子晶体的熔点,一定高于离子晶体”的说法是不对的. (2)同种晶体熔沸点比较. 对于同种晶体之间熔沸点的比较,如离子晶体,相互比较熔沸点的高低,只需比较离子键的强弱;如原子晶体之间比较熔沸点的高低,只需比较共价键的强弱;如分子晶体之间比较熔沸点的高低,只需比较共价键的强弱;如分子晶体之间比较熔沸点的高低,只需比较范德华力的大小. 原子晶体:原子半径越小,键长越短,键能越大,键越强,晶体熔沸点越高.如金刚石>碳化硅>晶体硅. 离子晶体:组成相似的离子晶体,离子半径越小,离子电荷数越大,离子键越强,晶体熔沸点越高.如KF>KCl>KBr;Al2O3>MgO. 分子晶体: ①具有氢键的分子晶体,其熔点非常的高.如HF>HI,H2O>H2S. ②组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高.如F2>Cl2>Br2>I2,HF<HCl<HBr<HI. ③烷烃的同分异构体,支链越多,熔沸点越低.
|


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com