
分析 (1)①②③④上述反应中的△H<0,所以都是放热反应;
(2)由①热化学方程式可知,消耗2g的氢气放出的热量为:285.8kJ;
(3)根据盖斯定律,③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;CO燃烧热的热化学方程式中的燃烧热为:④-③.
解答 解:(1))①②③④上述反应中的△H<0,所以都是放热反应,故答案为:①②③④;
(2)由①热化学方程式可知,消耗2g的氢气放出的热量为:285.8kJ,所以燃烧10g H2生成液态水,放出的热量为1429.0 kJ,故答案为:1429.0 kJ;
(3)根据盖斯定律,③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;CO燃烧热的热化学方程式中的燃烧热为:④-③,所以CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ/mol,故答案为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ/mol.
点评 本题考查了根据热化学方程式的计算以及盖斯定律的应用,有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:
1、所求反应中的反应物在哪个反应了?是反应物还是生成物?
2、所给反应中哪些物质是所求反应中没有的?
3、如何才能去掉无用的?然后,通过相互加减,去掉无关物质.将所对应的△H代入上述化学方程式的加减中就可以了.


科目:高中化学 来源: 题型:解答题
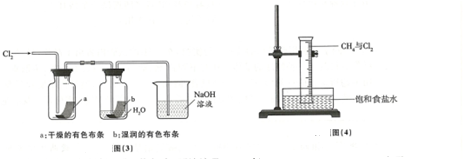
| 实验现象 | 原因 |
| 溶液从初的紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊试液变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)═Ca2++2OH- | B. | KNO3═K++NO3- | C. | NH4Cl═4NH++Cl- | D. | H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+.Na+.NO3-.H+ | B. | NH4+.Fe3+.SO42-.SCN- | ||
| C. | SO42-.Cl-.Cu2+.Mg2+ | D. | Ba2+.K+.SO32-.H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③⑥ | C. | ①⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空
A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙烷和氯气混合光照充分反应,可以制得比较纯净的氯乙烷 | |
| B. | 可以用质谱仪快速、微量、精确地测定它的相对分子质量 | |
| C. | 与其它卤代烃一样,不溶于水,能溶于有机溶剂 | |
| D. | 它在氢氧化钠水溶液中,可以水解发生取代反应,生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
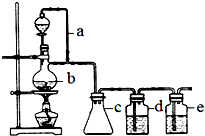 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com