
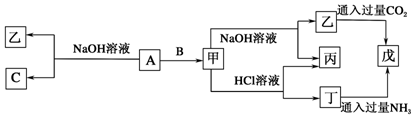
分析 甲既能与酸反应又能与碱反应,应为Al2O3或Al(OH)3,甲是工业上制取A的主要原料,甲应为Al2O3,且B能与NaOH反应,则A为Al,B为O2,C为H2O,乙为NaAlO2,丁为AlCl3,丙为H2O,戊为Al(OH)3,结合物质的性质解答该题.
解答 解:(1)由上述分析可知,A为Al,甲为Al2O3,乙为NaAlO2,丁为AlCl3,
故答案为:Al;Al2O3;NaAlO2;AlCl3;
(2)甲为Al2O3,硬度大,熔点高,作耐火材料,可做手表轴承或耐火材料,工业用电解Al2O3的方法冶炼铝,
故答案为:制取金属铝;作耐火材料;
(3)A与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,乙与过量CO2反应的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、相互转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,氧化铝的两性为推断的突破口,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1,2-二溴乙烷和1,1-二氯丙烷 | B. | 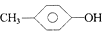 和 和 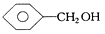 | ||
| C. | 苯 和 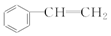 | D. | 丙炔 和 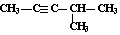 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短时间存放FeCl2溶液时,可添加少量铁粉防止Fe2+被氧化 | |
| B. | Na2CO3溶液存放在带玻璃塞的玻璃试剂瓶中 | |
| C. | 氢氟酸存放在玻璃试剂瓶中 | |
| D. | 钠单质存放在四氯化碳中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
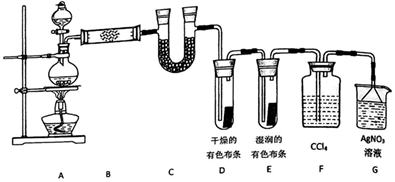
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶于水的电解质一定是强电解质 | |
| B. | 强电解质在水溶液中以离子形式存在 | |
| C. | 难溶于水的电解质一定是弱电解质 | |
| D. | 强电解质溶液的导电性一定比弱电解质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
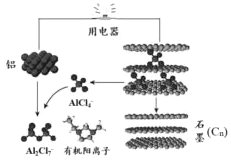 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时的阳极反应为:Cn+AlCl4--e-=CnAlCl4 | |
| B. | 放电时,铝为负极、石墨为正极 | |
| C. | 放电时,有机阳离子向铝电极方向移动 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-=4Al2Cl7- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑥⑦ | B. | 只有⑦ | C. | ④⑤⑦ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com