
【题目】用作检验碳酸根离子的试剂是( )
A.稀硫酸B.食盐水C.石灰水D.稀盐酸和澄清的石灰水
科目:高中化学 来源: 题型:
【题目】(化学-物质结构与性质)氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态15N原子的p能级上存在_____个自旋方向相同的电子;CN—中σ键与π键数目之比为_____。
(2)碱性肥料氰氨化钙(CaCN2)的组成元素中第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是____________________________________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为_______________。
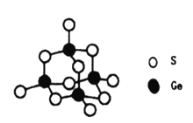
(4)阳离子[(CH3)3NH]+和阴离子A按个数比4:1组成化合物,阴离子A的结构如下图所示,则s原子的杂化轨道类型是__________,阴离子A的化学式为_______________。
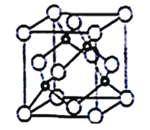
(5)立方氮化硼晶胞如下图所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为___;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
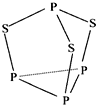
A. 该物质中磷元素的化合价为+3
B. 该物质22 g含硫原子的数目约为1.806×1023
C. 该物质分子结构中S、P最外层电子数均不为8
D. 该物质分子中不含非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外最外层共有24个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同
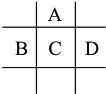
回答下列问题:
(1) A与E形成的化合物的化学式是__________.B的最高价氧化物化学式为_____________,
(2)D的单质与水反应的方程式为__________________________________________________.
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是___________________:有关反应的离子方程式为:_____________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2![]() N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
A. 平均反应速率A>B
B. 平衡时NO2的物质的量B>A
C. 平衡时NO2的转化率A>B
D. 平衡时N2O4的物质的量B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △Hl=-17kJ/mol;
H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=________。
H2(g)+CO2(g)的△H=________。
(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
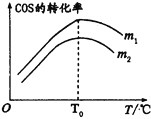 ①m1________m2(填>、<或=)。
①m1________m2(填>、<或=)。
②温度高于T0时,COS转化率减小的可能原因为_________。
A.有副反应发生。
B.反应的△H增大。
C.催化剂活性降低。
D.逆反应速率增大的倍数小于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是___________。
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为80%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=________。
②该温度下,上述反应的平衡常数K=________。
③其他条件相同时,既能使上述反应中COS的平衡转化率降低,又能使反应速率加快的做法是________。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com