
硫酸和盐酸的混合溶液20mL,在这溶液中加入0.025 mol/L氢氧化钡溶液时生成硫酸钡的量和溶液的pH值如图所示。

试计算:
(1)最初溶液中硫酸和盐酸的物质的量浓度
(2)A、B两点溶液的 pH值(溶液混合时体积变化忽略不计,pH值可以保留对数形式)。
(1)[H2SO4]=0.025 mol/L,[HCl]= 0.10 mol/L
(2)pHA=2-1g5 pHB=2-1g1.67
如图中曲线表明:跟硫酸反应生成硫酸钡沉淀消耗Ba(OH)2溶液20mL;而跟硫酸,盐酸进行中和反应,消耗Ba(OH)2溶液60mL。
(1)H2SO4+Ba(OH2)=BaSO4↓+2H2O ①
2HCl+Ba(OH)2=BaCl2+2H2O ②
反应①中,消耗Ba(OH)2的物质的量=0.025×0.020=5.0×10-4mol,
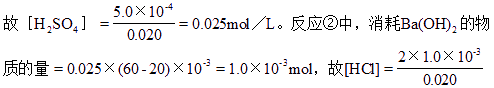
=0.10 mol/L。
![]()
B点H2SO4已被中和完全,部分HCl被中和。
已被中和的HCl的物质的量=0.025×(40-20)×10-3×2=1.0×10-3mol
![]()
所以,pHB=-1g1.67×10-2=2-1g1.67。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 向20mL硫酸和盐酸的混合溶液中,逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示.
向20mL硫酸和盐酸的混合溶液中,逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答:
往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原混合溶液中HCl的物质的量浓度。
(2)原混合溶液中的pH。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸和盐酸的混合溶液40 mL,加入0.1 mol·L-1 NaOH溶液40 mL恰好中和。如果加入足量Ba(OH)2溶液,可以生成0.233 g沉淀。试求:
(1)原混合溶液中HCl的物质的量浓度。
(2)原混合溶液中的pH。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com