
| A. | 从溴水中提取溴,可加入酒精作萃取剂 | |
| B. | 萃取操作完成后,静置分液,上、下层液体均从下口放出 | |
| C. | 用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层 | |
| D. | 萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应 |
分析 A.酒精与水混溶,而萃取剂不溶于水;
B.分液操作时下层液体从下口放出,上层液体从上口倒出;
C.有机溶剂的密度可能小于水;
D.萃取时,萃取剂与溶质不反应,且不相溶,出现分层.
解答 解:A.酒精与水混溶,不能用于萃取溴水中的溴,应用苯或四氯化碳,故A错误;
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,避免两种液体相互污染,故B错误;
C.有机溶剂的密度可能小于水,也可能大于水,可能在上层或下层,故C错误;
D.萃取时,萃取剂与溶质不反应,且不相溶,出现分层,则萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应即可,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的分离、提纯以及检验等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | Fe2+、NO3-、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
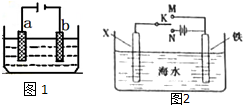 电化学原理在工业生产中有重要应用.如图1所示电解池中:
电化学原理在工业生产中有重要应用.如图1所示电解池中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 |
| 元素符号 | ①Na | ②Cl |
| 原子结构 示意图 |  | ③  |
| 周期 | 三 | 三 |
| 族 | ④IA | VII A |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物肯定是酸性氧化物 | |
| B. | 碱性氧化物肯定是金属氧化物 | |
| C. | 金属氧化物都是碱性氧化物 | |
| D. | 不能跟酸反应的氧化物一定能跟碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++HCO3- | B. | H2CO3═2H++CO32- | ||
| C. | NH3•H2O?NH4++OH- | D. | KAl(SO4)2═K++Al3++2SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中若混有乙烯,可通过酸性高锰酸钾溶液除去 | |
| B. | 乙醇中是否混有水,可用加入金属钠是否产生气体进行检验 | |
| C. | 蚕丝和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+ | |
| B. | 向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+ | |
| C. | 向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32- | |
| D. | 用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com