
| A、第二周期,ⅢA族 |
| B、第二周期,ⅦA族 |
| C、第五周期,ⅡA族 |
| D、第七周期,ⅡA族 |
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
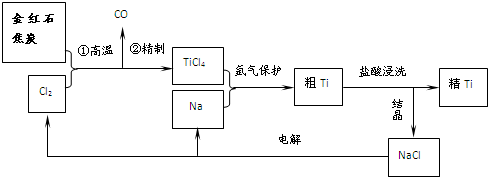
查看答案和解析>>
科目:高中化学 来源: 题型:
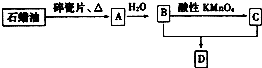 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).查看答案和解析>>
科目:高中化学 来源: 题型:

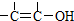 结构的物质不能稳定存在.
结构的物质不能稳定存在.查看答案和解析>>
科目:高中化学 来源: 题型:
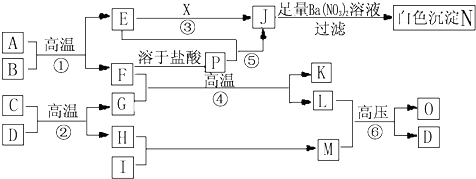
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com