
分析 (1)反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,再根据元素守恒确定其它物质的系数,配平方程式,根据“双线桥法”标明电子转移的方向和数目;
(2)化合价降低的元素在反应中被还原,发生还原反应;根据n=$\frac{V}{Vm}$计算氯气的物质的量,被氧化的HCl为生成Cl2,根据氯元素守恒计算被氧化的HCl,根据方程式计算需要高锰酸钾的质量,根据氯气的物质的量计算转移电子物质的量,再根据N=nNA计算转移的电子数目.
解答 解:(1)反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,根据Mn元素守恒可知MnCl2系数为2,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为16,根据H元素可知H2O的系数为8,配平后方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,用“双线桥法”标明电子转移的方向和数目为: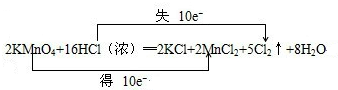 ,
,
故答案为:2、16、2、2、5、8; ;
;
(2)反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,Cl2是氧化产物;反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4是氧化剂,发生还原反应;560mlCl2的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,被氧化的HCl为生成Cl2,根据氯元素守恒可知被氧化的HCl为0.025mol×2=0.05mol;反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,故转移电子物质的量为0.025mol×2=0.05mol,转移电子数目为0.05mol×NAmol-1=0.05NA;
故答案为:还原;0.05;0.05NA.
点评 本题考查氧化还原反应配平和基本概念、有关计算等,难度中等,注意掌握氧化还原反应配平常用方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题


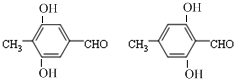 (任意一种);.
(任意一种);.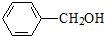 为原料制备
为原料制备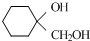 的反应合成路线流程图(无机试剂任用).
的反应合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HC1 | B. | 2CH3CH2OH+02$\stackrel{Cu、△}{→}$2CH3CH0+2H20 | ||
| C. | 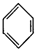 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$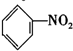 +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$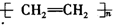 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.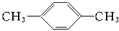 .
. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
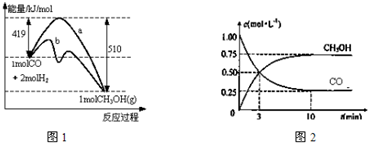
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
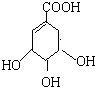 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图: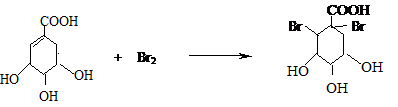 .
.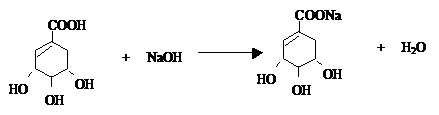 .
.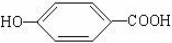 ),其反应类型消去反应.
),其反应类型消去反应.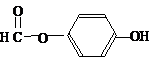 或
或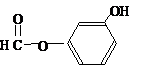 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入适量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 电镀铜时阳极反应为:Cu2++2e-=Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com