
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
分析 分子式为C5H8O2的有机物,其不饱和度为$\frac{5×2+2-8}{2}$=2,能水解且能发生银镜反应,说明分子中含有H-COO-,C=C,即分子可以看成是甲酸和丁烯醇反应的产物,根据丁烯醇的种类确定产物的种类;
解答 解:分子式为C5H8O2的有机物,其不饱和度为$\frac{5×2+2-8}{2}$=2,能水解且能发生银镜反应,说明分子中含有H-COO-,C=C,即分子可以看成是甲酸和丁烯醇反应的产物,丁烯有:1-丁烯、2-丁烯、2-甲基丙烯三种,用羟基取代丁烯上的氢原子分别得到4种、2种、2种丁烯醇,所以符合上述条件同分异构体有8种,故选A.
点评 本题考查同分异构体的书写,难度不大,通过性质判定含有的官能团,通过碳链异构和位置异构确定有机物种数.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
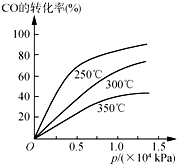 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
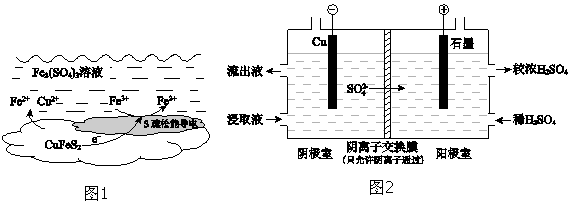
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 62(a+b)g | B. | 186(a+b)g | C. | (cV-$\frac{a+b}{3}$)mol | D. | (cV-$\frac{9a+b}{3}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
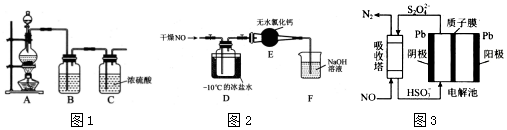
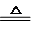 MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体.
MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比 12C 多两个质子 | B. | 与 12C 化学性质相似 | ||
| C. | 与 12C 互为同素异形体 | D. | 质子数与中子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应后的质量/g | 未测定 | 21 | 10 | 9 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | ① | ② | 实验现象 | 结论 | |
 | A | 铜丝 | 稀硝酸 | ②中出现红棕色气体 | 稀硝酸与铜生成了NO2 ③中需要碱溶液吸收尾气 |
| B | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液 发生置换反应 | |
| C | 铁丝 | 饱和 食盐水 | ③中导管内液面上升 | 铁钉发生吸氧腐蚀 | |
| D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com