
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡_________移动(填“向左”,“向右”或“不”);其pH值变__________(填“增大”、“减小”或“无法确定”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中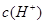 和
和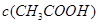 的比值将____________(填“增大”、“减小”或“无法确定”),其pH值变__________(填“增大”、“减小”或“无法确定”)
的比值将____________(填“增大”、“减小”或“无法确定”),其pH值变__________(填“增大”、“减小”或“无法确定”)
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为: ______
______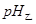 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(3)各取25mL的甲、乙两溶液,分别用等浓度的 稀溶液中和至
稀溶液中和至 ,则消耗的
,则消耗的 溶液的体积大小关系为:
溶液的体积大小关系为: ______
______ (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(4)取25mL的甲溶液,加入等体积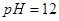 的
的 溶液,反应后溶液中
溶液,反应后溶液中 、
、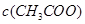 的大小关系为:
的大小关系为: ______
______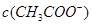 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高二12月质检化学试卷(解析版) 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中[Na+]、[CH3COO-]的大小关系为:[Na+]________[CH3COO-]。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省宿州市高二上学期期末考试化学试卷(解析版) 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至
pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中
[Na+]、[CH3COO-]的大小关系为:[Na+]________[CH3COO-]。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com