
| A. | 自然界里没有任何一种食物能同时满足人体对各种维生素的需要 | |
| B. | 用于2008年北京奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| D. | 葡萄糖、蔗糖、纤维素和脂肪在一定条件下都可以发生水解反应 |
分析 A.一种食物不可能含有所有维生素;
B.丙烷充分燃烧只生成二氧化碳和水;
C.乙醇被氧化生成乙酸,可与乙酸反应生成乙酸乙酯;
D.葡萄糖为单糖,不能水解.
解答 解:A.一种食物不可能含有所有维生素,满足人体对各种维生素的需要,故A正确;
B.丙烷充分燃烧只生成二氧化碳和水,为清洁燃料,故B正确;
C.乙醇被氧化生成乙酸,可与乙酸反应生成乙酸乙酯,则用大米酿的酒在一定条件下密封保存,时间越长越香醇,故C正确;
D.葡萄糖为单糖,不能水解,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,为解答该类题目的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.
将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验 | |
| B. | 鉴别溶液中是否有SO42-,用盐酸酸化 | |
| C. | 为抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
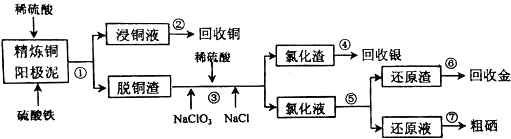
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和SO2 | B. | 甲醛和苯等有机物 | ||
| C. | SO2和NO2 | D. | O3和Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合小苏打和烧碱溶液 HCO3-+H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入氨水Al3++3OH-═Al(OH)3↓ | |
| C. | 加热碳酸氢钙溶液 Ca2++2HCO3-═CaCO3↓+H2O+CO2↑ | |
| D. | 氢氧化镁中加入稀硫酸H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 污 染 指 数 | 首要 污染物 | 空气 质量等级 | ||
| SO2 | NO2 | PM10 | ||
| 23 | 35 | 56 | PM10 | 良 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CCl4所含原子数目为2.5NA | |
| B. | 常温常压下,64g SO2中含有的原子数为3NA | |
| C. | 将1 mol Cl2通入水中能生成1mol HClO | |
| D. | 2L 0.1 mol•L-1K2SO4溶液中含K+物质的量为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
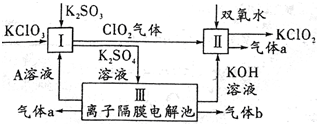 氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.
氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com