
·ÖĪö £Ø1£©¢Łøł¾Żn=$\frac{V}{{V}_{m}}$¼ĘĖć»ģŗĻĘųĢåµÄĪļÖŹµÄĮ棬ŌŁøł¾ŻM=$\frac{m}{n}$¼ĘĖć³öĘ½¾łÄ¦¶ūÖŹĮ棻
¢Śøł¾ŻÖŹĮæŹŲŗć¶ØĀɼĘĖć³ö»ģŗĻĪļÖŠŗ¬ÓŠĢ¼Ō×ÓµÄĪļÖŹµÄĮ棻
¢ŪÉčCOÓėCO2µÄĪļÖŹµÄĮæ·Ö±šĪŖxmol”¢ymol£¬øł¾Ż¶žÕßÖŹĮæ¼°ĪļÖŹµÄĮæĮŠ·½³Ģ½ā“š£»
£Ø2£©øł¾Żm=¦ŃV¼ĘĖćĖ®µÄÖŹĮ棬ŌŁøł¾Żn=$\frac{m}{M}$¼ĘĖćĖ®µÄĪļÖŹµÄĮ棻øł¾Żn=$\frac{N}{{N}_{A}}$¼ĘĖćHCl”¢HeµÄĪļÖŹµÄĮ棻øł¾Żn=$\frac{m}{M}$¼ĘĖćSO2ĪļÖŹµÄĮ棻½įŗĻĆæøö·Ö×Óŗ¬ÓŠµÄŌ×ÓŹżÄæ¼ĘĖćŗ¬ÓŠŌ×Ó×ÜĪļÖŹµÄĮ棬עŅāĻ”ÓŠĘųĢåĪŖµ„Ō×Ó·Ö×Ó£¬¾Ż“Ė½ā“š£»
£Ø3£©ĄūÓĆc=$\frac{1000¦Ń¦Ų}{M}$¼ĘĖćĮņĖįµÄĪļÖŹµÄĮæÅØ¶Č£¬ŌŁøł¾ŻĮņĖįČÜŅŗµÄÅضČŌ½“óĆܶČŅ²Ō½“󣬽ųŠŠÅŠ¶Ļ£»
£Ø4£©Éč·Ö½āŗóÉś³ÉAm£¬ŌņÓŠ2mAH3=2Am+3mH2£¬øł¾Ż·“Ó¦Ē°ŗóĪļÖŹµÄĮæµÄ¹ŲĻµ¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©¢Ł»ģŗĻĘųĢåµÄĪļÖŹµÄĮæĪŖ£ŗ$\frac{11.2L}{22.4L/mol}$=0.5mol£¬»ģŗĻĘųĢåĘ½¾łÄ¦¶ūÖŹĮæĪŖ£ŗ$\frac{15g}{0.5mol}$=30g/mol£¬¹Ź“š°øĪŖ£ŗ30g/mol£»
¢Śøł¾Ż·Ö×ÓŹ½CO”¢CO2æÉÖŖ£¬Ģ¼Ō×ÓµÄĪļÖŹµÄĮæÓė»ģŗĻĘųĢåµÄĪļÖŹµÄĮæĻąµČ£¬ĖłŅŌ»ģŗĻĘųĢåÖŠĢ¼Ō×ÓµÄĪļÖŹµÄĮæĪŖ0.5mol£¬¹Ź“š°øĪŖ£ŗ0.5mol£»
¢ŪÉčCOÓėCO2µÄĪļÖŹµÄĮæ·Ö±šĪŖxmol”¢ymol£¬øł¾Ż¶žÕßÖŹĮæ¼°ĪļÖŹµÄĮ棬Ōņx+y=0.5”¢28x+44y=15£¬½āµĆ£ŗx=$\frac{7}{16}$”¢y=$\frac{1}{16}$£¬¹ŹCO2ŗĶCOµÄĢå»żÖ®±ČŹĒ$\frac{1}{16}$mol£ŗ$\frac{7}{16}$mol=1£ŗ7£¬¹Ź“š°øĪŖ£ŗ1£ŗ7£»
£Ø2£©¢Ł0.112LĖ®µÄÖŹĮæĪŖ112g£¬ĘäĪļÖŹµÄĮæ=$\frac{112g}{18g/mol}$=6.2mol£¬ŗ¬ÓŠŌ×ÓĪļÖŹµÄĮæ=6.2mol”Į3=18.6mol£»
¢Ś0.5NAøöHCl·Ö×ÓµÄĪļÖŹµÄĮæ=$\frac{0.5NA}{NA}$=0.5mol£¬ŗ¬ÓŠŌ×ÓĪļÖŹµÄĮæ=0.5mol”Į2=1mol£»
¢Ū25.6g SO2ĘųĢåµÄĪļÖŹµÄĮæ=$\frac{25.6g}{64g/mol}$=0.4mol£¬ŗ¬ÓŠŌ×ÓĪļÖŹµÄĮæ=0.4mol”Į3=1.2mol£»
¢Ü0.2mol°±ĘųÖŠŗ¬ÓŠŌ×ÓĪļÖŹµÄĮæ=0.2mol”Į4=0.8mol£»
¢Żŗ¤ĘųĪŖµ„Ō×Ó·Ö×Ó£¬2molŗ¤ĘųÖŠŗ¬ÓŠŌ×ÓĪŖ2mol£»¹Źŗ¬ÓŠŌ×ÓŹżÄæ£ŗ¢Ł£¾¢Ż£¾¢Ū£¾¢Ś£¾¢Ü£¬
¹Ź“š°øĪŖ£ŗ¢Ł£¾¢Ż£¾¢Ū£¾¢Ś£¾¢Ü£»
£Ø3£©Éč½«ČÜÖŹÖŹĮæ·ÖŹżĪŖa%µÄĮņĖįČÜŅŗĆܶČĪŖ¦Ń1£¬
Ōņc1=$\frac{1000”Į{¦Ń}_{1}”Įa%}{98}$mol/L=$\frac{10a{¦Ń}_{1}}{98}$mol/L£¬
Éč½«ČÜÖŹÖŹĮæ·ÖŹżĪŖ2a%µÄĮņĖįČÜŅŗĆܶČĪŖ¦Ń2£¬
Ōņc2=$\frac{1000”Į{¦Ń}_{2}”Į2a%}{98}$mol/L=$\frac{20a{¦Ń}_{2}}{98}$mol/L£¬
ĖłŅŌc1£ŗc2=$\frac{10a{¦Ń}_{1}}{98}$mol/L£ŗ$\frac{20a{¦Ń}_{2}}{98}$mol/L=¦Ń1£ŗ2¦Ń2£¬
¼“c2=$\frac{2{¦Ń}_{2}}{{¦Ń}_{1}}$c1
ĮņĖįČÜŅŗµÄÅضČŌ½“óĆܶČŅ²Ō½“ó£¬ĖłŅŌ¦Ń2£¾¦Ń1£¬ĖłŅŌ$\frac{2{¦Ń}_{2}}{{¦Ń}_{1}}$£¾2£¬ĖłŅŌc2£¾2c1£¬
¹Ź“š°øĪŖ£ŗ2c1£¼c2£»
£Ø4£©Éč·Ö½āŗóÉś³ÉAm£¬ŌņÓŠ2mAH3=2Am+3mH2£¬ĆܱÕČŻĘ÷ÖŠĘųĢå·Ö×Ó×ܵÄĪļÖŹµÄĮæŌö¼ÓĮĖ75%£¬
ŌņÓŠ$\frac{2+3m}{2m}$=1+0.75£¬
m=4£¬
æɵƷ“Ó¦µÄ·½³ĢŹ½ĪŖ4AH3=A4+6H2£¬
¹Ź“š°øĪŖ£ŗ4AH3=A4+6H2£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄĮæÓŠ¹Ų¼ĘĖć”¢Ī¢Į£ŹżÄæ¼ĘĖć£¬±Č½Ļ»ł“”£¬×¢ŅāĄķ½ā»ÆѧŹ½µÄŅāŅ壮



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µ„ÖŹ | B£® | »ÆŗĻĪļ | C£® | »ģŗĻĪļ | D£® | “æ¾»Īļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1mol/LHNO3ČÜŅŗ | B£® | 0.1mol/LH2SO4ČÜŅŗ | ||
| C£® | 0.1mol/LBa£ØOH£©2ČÜŅŗ | D£® | 0.1mol/LNaOHČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ɳĄļĢŌ½š£¬ĄūÓĆĮĖɳ×ÓŗĶ½š×ÓµÄĆÜ¶Č²»Ķ¬ | |
| B£® | ŗ£Ė®É¹ŃĪ£¬ĄūÓĆĮĖĖ®ŗĶNaClµÄ·Šµć²»Ķ¬ | |
| C£® | ¾ĘŌćÄš¾Ę£¬ĄūÓĆĮĖĮøŹ³ŗĶ¾Ę¾«·Ö×ÓµÄæÅĮ£“󊔲»Ķ¬ | |
| D£® | Ö²ĪļÓĶÄÜŻĶČ”Źß²ĖÖÖŠµÄÖ²Īļ¾«»Ŗ--Ī¬ÉśĖŲ£¬ĄūÓĆĮĖĪ¬ÉśĖŲŌŚĖ®ŗĶÓĶÖŠČܽā¶Č²»Ķ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘĻĢŃĢĒĖįÄĘŹĒ·Ēµē½āÖŹ | |
| B£® | “«Ķ³µÄĀČ»ÆÄĘČŚŃ©¼ĮÓÉÓŚ¼ŪøńĘ«ø߶ų¼õÉŁŹ¹ÓĆ | |
| C£® | “óĮæŹ¹ÓĆ“«Ķ³µÄĀČ»ÆÄĘČŚŃ©¼Į»įŌģ³ÉÖ²ĪļæŻĖĄ | |
| D£® | “«Ķ³µÄĀČ»ÆÄĘČŚŃ©¼ĮĶعżÉżøßĖ®µÄÄż¹ĢµćŹµĻÖŃ©ČŚ»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚĮæĶ²ÖŠ¼ÓČėŅ»Ģå»żµÄĖ®£¬ŌŁ¼ÓČėÅØĮņĖįÅäÖĘĻ”ĮņĖį | |
| B£® | ÓĆ³ĪĒåŹÆ»ŅĖ®¼ģŃéCOÖŠŗ¬ÓŠµÄCO2 | |
| C£® | ÓĆ²£Į§°ō½Į°čĀ©¶·ÖŠµÄŅŗĢåŅŌ¼Óæģ¹żĀĖĖŁ¶Č | |
| D£® | ¼ÓČėŃĪĖįŅŌ³żČ„ĮņĖįÄĘÖŠµÄÉŁŠķĢ¼ĖįÄĘŌÓÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | O2 | B£® | CO2 | C£® | H2 | D£® | SO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
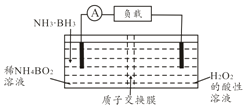 Ö±½Ó°±ÅšĶé£ØNH3•BH3£©µē³ŲæÉŌŚ³£ĪĀĻĀ¹¤×÷£¬×°ÖĆČēĻĀĶ¼£¬øƵē³ŲµÄ×Ü·“Ó¦ĪŖNH3•BH3+3H2O2ØTNH4BO2+4H2O£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
Ö±½Ó°±ÅšĶé£ØNH3•BH3£©µē³ŲæÉŌŚ³£ĪĀĻĀ¹¤×÷£¬×°ÖĆČēĻĀĶ¼£¬øƵē³ŲµÄ×Ü·“Ó¦ĪŖNH3•BH3+3H2O2ØTNH4BO2+4H2O£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | ×ó²ąµē¼«·¢Éś»¹Ō·“Ó¦ | |
| B£® | µē³Ų¹¤×÷Ź±£¬H+ĶعżÖŹ×Ó½»»»Ä¤Ļņøŗ¼«ŅĘ¶Æ | |
| C£® | Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ2H++2e-=H2”ü | |
| D£® | ĻūŗÄ3.1g°±ÅšĶ飬ĄķĀŪÉĻ×ŖŅĘ0.6molµē×Ó |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com