
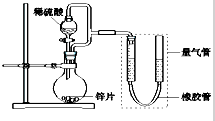
 某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.| 序号 | V(H2SO4)/ml | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
| V |
| 22.4 |
| V |
| 22.4 |
| 65V |
| 22.4m |
| 65V |
| 22.4m |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、含NA个分子的氮气 |
| B、标准状况下3.36L甲烷 |
| C、5.4 g水(水的摩尔质量为18g?mol-1) |
| D、0.4mol三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、s能级的能量总是小于p能级的能量 |
| B、2s的电子云比1s的电子云大,说明2s的电子云中的电子比1s的多 |
| C、当电子排布在同一能级的不同轨道时,电子总是先占满1个轨道,然后再占据其他原子轨道 |
| D、nf能级中最多可容纳14个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
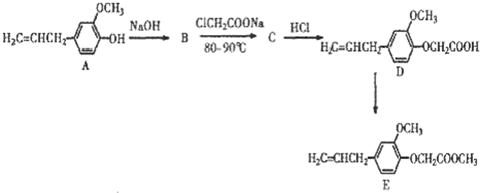
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n[CO]/mol | n[H2O]/mol |
| 0 | 1.8 | 0.9 |
| 2 | 1.2 | x |
| 4 | y | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图Ⅰ可表示对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 |
| B、图Ⅱ可表示体积都为1L,pH=2的盐酸和醋酸溶液分别与0.65g锌粒反应生成氢气速率的快慢 |
| C、图Ⅲ表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、p1<p2 |
| D、图Ⅳ可表示将等体积pH=2的盐酸和醋酸分别加水稀释过程中pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、C3N3(OH)3与HNCO为同一物质 |
| B、HNCO是一种很强的氧化剂 |
| C、1molNO2在反应中转移的电子为4mol |
| D、CO2既不是氧化产物,也不是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液BaCl2溶液,碳酸钠溶液,过滤后加盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在蒸发皿中加热制无水MgCl2 |
| C、在第④步中的反应离子方程式为Br2+SO2+2H2O=2H++SO42-+2HBr |
| D、第⑤步涉及的分离操作有过滤、萃取、蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com