
【题目】磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
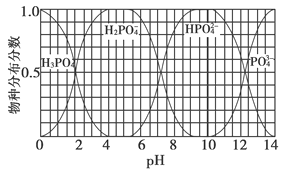
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷(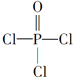 )与季戊四醇(
)与季戊四醇(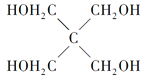 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
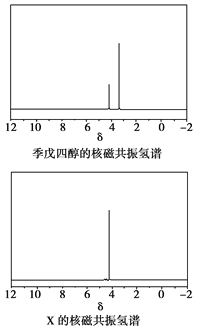
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
【答案】(1)2821.6 (2)3 mol (3)①4~5.5(介于此区间内的任意值或区间均可) c(HPO42—)>c(H2PO4—)
②3Ca2++2HPO42—=Ca3(PO4)2↓+2H+
(4)①HCl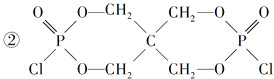
【解析】应用化学反应原理分析相关问题,得出合理答案。
(1)2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH=+3359.26 kJ·mol-1①
CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-89.61 kJ·mol-1②根据盖斯定律,①+②×6得ΔH3=+2821.6 kJ·mol-1。
(2)该反应中,Cu2+转化为Cu+,则60 mol CuSO4转移60 mol e-,![]() ,1 mol P4被CuSO4氧化时得20 mol e-,所以60 mol CuSO4可以氧化3 mol P4。
,1 mol P4被CuSO4氧化时得20 mol e-,所以60 mol CuSO4可以氧化3 mol P4。
(3)根据图像可知获得纯净的NaH2PO4应控制pH在4~5.5之间。pH=8时溶质主要是Na2HPO4和NaH2PO4。此时c(HPO42—)>c(H2PO4—)。加入CaCl2后,Ca2+结合HPO42—电离出的PO42—生成沉淀,促进了HPO42—的电离,反应的离子方程式为3Ca3++2HPO42—=Ca3(PO4)2↓+2H+。
(4)根据元素种类可以判定酸性气体是HCl,根据元素守恒及反应物季戊四醇的核磁共振氢谱、生成物X的核磁共振氢谱推出反应为
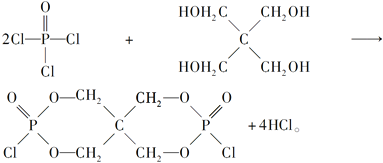
点拨:知识:反应热计算、氧化还原反应、离子浓度大小比较、离子方程式等。能力:考查学生对化学知识综合运用、解决问题的能力。试题难度:较大。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】乙烯和乙醇的混合气体VL,完全燃烧后生成二氧化碳和水,消耗相同状态下的氧气3VL,则混合气体中乙烯和乙醇的体积比是( )
A. 1∶1B. 2∶1C. 1∶2D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往某酸的钠盐Na2A溶液中通入HCl,溶液中-lg![]() 和-lgc(HA-)或-lg
和-lgc(HA-)或-lg![]() 和-1gc(A2-)的关系如图所示。下列说法正确的是( )
和-1gc(A2-)的关系如图所示。下列说法正确的是( )
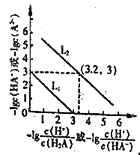
A. 直线L2表示-lg![]() 和-lgc(HA-)的关系
和-lgc(HA-)的关系
B. 通入HCl过程中,水电离的c(OH-)与水电离的c(H+)的乘积不断增大
C. c(H2A)的数量级为10-7
D. 在NaHA溶液中c(Na+)>(HA-)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由12CO和14CO组成的混合气体对氦气的相对密度为7.125,则混合气体中12C和14C的原子个数比为( )
A. 1∶1 B. 1∶2 C. 3∶1 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1mol/LNa2CO3溶液:c(OH-)=c(H2CO3)+c(HCO3-)+c(H+)
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1-10的元素中,满足上述关系的元素共有
A. 2组 B. 4组 C. 5组 D. 6组
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : l 的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,有关该反应的下列说法正确的是
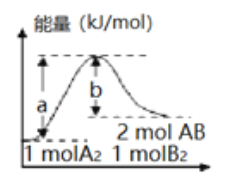
A. 每生成2 mol AB分子,需要吸收b kJ热量
B. 加入催化剂,(a-b)的差值减小
C. 该反应的反应物断键吸收的能量大于生成物成键放出的能量
D. 若反应生成AB为液态,每生成2 mol AB分子,需要吸收的热量大于(a-b) kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com