
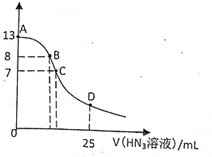
| A. | 水电离出的c(H+):A点小于B点 | |
| B. | 在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5 mL | |
| D. | 在D点,c(Na+)=2c(HN3)+2 c(N3-) |
分析 A.A点为氢氧化钠溶液,B点为氢氧化钠和NaN3的混合液,氢氧化钠浓度越小,水的电离程度越大;
B.B点呈碱性,则c(OH-)>c(H+),由于pH=8,氢离子、氢氧根离子浓度较小,则c(Na+)>c(N3-)>c(OH-)>c(H+);
C.当加入12.5mLHN3(叠氮酸)溶液时,恰好反应生成NaN3,N3-部分水解,溶液呈碱性;
D.根据D点的物料守恒判断.
解答 解:A.A点为氢氧化钠溶液,氢氧化钠浓度越大,水的电离程度越小,B点为氢氧化钠和NaN3的混合液,N3-水解促进了水的电离,则水电离出的c(H+):A点小于B点,故A正确;
B.B点呈碱性,则c(OH-)>c(H+),由于pH=8,混合液中的氢离子、氢氧根离子浓度较小,则正确的离子浓度大小为:c(Na+)>c(N3-)>c(OH-)>c(H+),故B错误;
C.滴加的V(HN3)=12.5 mL时,恰好反应生成NaN3,N3-部分水解,溶液呈碱性,而C点溶液的pH=7,所以C点V(HN3)>12.5 mL,故C错误;
D.在D点,V(HN3)=25 mL,根据物料守恒可知:2c(Na+)=c(HN3)+c(N3-),故D错误;
故选A.
点评 本题考查了酸碱混合的定性判断及溶液pH计算、离子浓度大小比较,题目难度中等,明确图象曲线对应溶质组成为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解原理判断离子浓度大小,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定过程中不小心将液体从锥形瓶溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室以2一丁醇(
实验室以2一丁醇( )为原料制备2-氯丁烷
)为原料制备2-氯丁烷 ),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:
),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:| 物质 | 熔点 (℃) | 沸点(℃) |
| 2-丁醇 | -114.7 | 99.5 |
| 2-氯乙烷 | -131.3 | 68.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Cl-、K+ | B. | Na+、Fe2+、Cl-、NO3- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯胺处理自来水:NH2Cl+H2O?NH2OH+HCl | |
| B. | 在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水:Ca2++Mg2++2OH-+2HCO3-═CaCO3↓+MgCO3↓+2H2O | |
| C. | 长时间煮沸含Mg2+、HCO3-的自来水:Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑ | |
| D. | Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为:Fe3++3H2O═Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>H2S | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 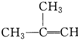 -CH3+Br2→ -CH3+Br2→ | |
| B. | CH2=CH-CH3+HCl→ | |
| C. | CH2=CH-CH=CH2+Br2→ | |
| D. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com