
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | 化学反应的本质就是原子之问的电子转移 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 英国化学家波义尔提出元素的概念,标志着近代化学的诞生 |
分析 A、在标准状况下,1mol任何气体的体积都约是22.4L;
B、化学反应的本质就是原子之间的重新组合;
C、在化学反应中,参加反应的各物质的物质的量之比等于其计量数之比;
D.英国化学家波义耳1661年提出化学元素的概念,标志着近代化学的诞生.
解答 解:A、在标准状况下,1mol任何气体的体积都约是22.4L,则在一定条件下,1mol任何气体的体积可能为22.4L,故A错误;
B、化学反应的本质就是原子之间的重新组合,故B错误;
C、在化学反应中,参加反应的各物质的质量比等于方程式中各物质化学计量数和该物质的相对分子质量乘积之比,故C错误;
D、英国化学家波义耳1661年提出化学元素的概念,标志着近代化学的诞生,故D正确.
故选D.
点评 本题考查较为综合,但比较简单,注意一些化学常识的积累.注意根据化学方程式进行计算时,已知物质的其他物理量一般可换算成物质的量,再根据化学方程式中的化学计量数之比等于物质的量之比分析解答.


科目:高中化学 来源: 题型:解答题


 ;
; ;
; 的最合理的方案.用合成反应流程图表示,书写模式如下:
的最合理的方案.用合成反应流程图表示,书写模式如下:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L AlCl3溶液 | B. | 200 mL 1 mol/L MgCl2溶液 | ||
| C. | 100 mL 0.5 mol/L CaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  | 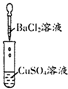 | 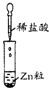 |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
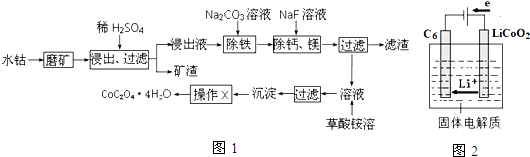
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com