
 ,其晶体中的化学键类型为离子键、共价键
,其晶体中的化学键类型为离子键、共价键分析 (1)首先判断化合物是离子化合物还是共价化合物;若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况,次氯酸钠是离子化合物;
(2)NaClO溶液中通入少量SO2过程中发生氧化还原反应生成硫酸钠;
(3)1)依据反应生成的产物结合“ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低”解答;
2)二氧化氯具有强的氧化性,能够氧化二价锰离子生成二氧化锰,本身被还原为氯离子;
3)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到;
(4)阳极发生氧化反应,由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,结合电荷守恒可知,同时生成氢离子;
(5)应先写出二者反应的方程式或关系式(ClO2~CN-)然后计算;
解答 解:(1)NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为 ,晶体中含化学键类型为离子键和共价键,
,晶体中含化学键类型为离子键和共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(2)向NaClO溶液中通入少量SO2的离子反应为3ClO-+SO2+H2O═2HClO+SO42-+Cl-,
故答案为:3ClO-+SO2+H2O═2HClO+SO42-+Cl-;
(3)ClO2常温下为橘黄色气体,性质不稳定,易引起爆炸,若用稀有气体或N2、CO2等稀释时,爆炸性则大大降低.ClO2可由KClO3和草酸(H2C2O4)混合物中加入足量的稀硫酸水浴加热制得,
1)用H2C2O4溶液、稀硫酸和KC1O3制备ClO2反应产物为二氧化氯、二氧化碳可稀释ClO2,大大降低爆炸的可能性,
故答案为:制得ClO2的同时有CO2产生,可稀释ClO2,大大降低爆炸的可能性;
2)二氧化氯具有强的氧化性,能够氧化二价锰离子生成二氧化锰,本身被还原为氯离子,离子方程式:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+;
故答案为:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+;
3)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为:CH2OH(CHOH)4CHO+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4,
故答案为:CH2OH(CHOH)4CHO+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4;
(4)阳极发生氧化反应,由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,结合电荷守恒可知,同时生成氢离子,阳极电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
(5)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为$\frac{100ag}{26g/mol}$=$\frac{50a}{13}$mol,由方程式可知,至少需要ClO2的物质的量=$\frac{50a}{13}$mol,
故答案为:$\frac{50a}{13}$;
点评 本题考查氧化还原反应、物质性质,题目难度中等,涉及氧化还原反应的计算、化学方程式、离子方程式的书写等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力,本题考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{Z}^{Y}$R | B. | ${\;}_{Z}^{Y+Z}$R | C. | ${\;}_{Z+X}^{Y+Z}$R | D. | ${\;}_{Z+X}^{Y+X+Z}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl═NH3↑+HCl↑ | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | 2NaOH+Cl2═NaCl+NaClO+H2O | D. | 2NO+2CO$\stackrel{一定条件}{?}$N2+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

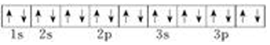
| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>②>④ | D. | ①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,以提高固体的纯度 | |
| B. | 洗涤的操作:向过滤器里的固体直接注入洗涤剂浸没固体,待洗涤剂自然流下,重复操作2~3次即可 | |
| C. | 洗涤的试剂根据需要一般可选用蒸馏水、冰水、乙醇或该物质的饱和溶液 | |
| D. | 是否洗净的检验:取最后一次洗涤液,鉴别含有形成相应沉淀或晶体的该溶液中的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,pH均为4的H2SO4、(NH4)2SO4的溶液中,水的电离程度相同 | |
| B. | 室温时,Ka=1×10-5浓度为0.1 mol/L的HA溶液,pH≈3 | |
| C. | 在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液$\frac{c(C{l}^{-})}{c(B{r}^{-})}$增大 | |
| D. | 25℃时,向20 mL 0.01 mol/L的醋酸溶液中滴加10 mL 0.01 mol/L的KOH溶液,混合溶液后呈酸性:c(K+)+c(H+)<c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个横行,7个周期 | B. | 元素周期表有16个纵行,16个族 | ||
| C. | ⅠA 族的元素全部是金属元素 | D. | 0族元素的原子最外层都有8个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com