
【题目】某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验。
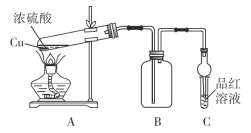
甲组取a g铜片和一定量的浓硫酸放入试管中加热,直到反应完毕,最后发现试管中还有一定量的H2SO4和Cu剩余。
(1)写出装置A中所发生反应的化学方程式:_______________________________。
(2)若用含0.2 mol H2SO4的浓硫酸与过量铜片共热,能否收集到0.1 mol SO2:______(填“能”或“不能”)。
(3)当集气瓶B中的气体收集满时,装置C中有可能观察到的现象是_____________。
(4)为什么有一定量的余酸却未能使Cu完全溶解,你认为原因是_________________。
(5)乙组同学认为:实验装置C有可能造成环境污染,乙组同学设计了最简单方法给予解决:在C试管口塞上一团沾有_________(填化学式)溶液的棉花。
(6)为了证明反应结束后的试管中的确有剩余的稀硫酸,可选择的试剂是_______。
A.铁粉 B.Na2CO3溶液 C.BaCl2溶液 D.NaOH溶液
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 不能 品红溶液褪色 稀硫酸不能与Cu反应 NaOH AB
CuSO4+SO2↑+2H2O 不能 品红溶液褪色 稀硫酸不能与Cu反应 NaOH AB
【解析】
(1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水;
(2)加热条件下,浓硫酸和Cu反应生成二氧化硫,但稀硫酸和铜不反应;
(3)二氧化硫具有漂白性,能使品红溶液褪色;
(4)稀硫酸和Cu不反应;
(5)二氧化硫属于酸性氧化物,能和碱反应生成盐和水;
(6)稀硫酸具有酸性,能和较活泼金属发生置换反应,能和弱酸盐反应生成弱酸。
(1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)加热条件下,浓硫酸和Cu反应生成二氧化硫,但稀硫酸和铜不反应,且参加反应的硫酸中只有一半作氧化剂,所以二氧化硫的物质的量是参加反应的硫酸物质的量的一半,若用含0.2molH2SO4的浓硫酸与过量铜片共热,由于随着反应的进行,浓硫酸浓度逐渐减小,因此参加反应的硫酸的物质的量小于0.2mol,则生成二氧化硫的物质的量小于0.1mol;
(3)二氧化硫能和品红溶液反应生成无色物质而具有漂白性,能使品红溶液褪色,所以C中看到的现象是品红溶液褪色;
(4)加热条件下浓硫酸和Cu反应,而稀硫酸和Cu不反应,由于随着反应的进行,浓硫酸浓度逐渐减小,所以有一定量的余酸,却未能使Cu完全溶解;
(5)二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以可以在C试管口塞上一团沾有NaOH溶液的棉花,用来吸收二氧化硫,防止污染大气;
(6)稀硫酸具有酸性,能和较活泼金属发生置换反应,能和弱酸盐反应生成弱酸,则:
A.铁和稀硫酸反应生成氢气,所以该反应能鉴定是否含有稀硫酸,故A正确;
B.碳酸钠和稀硫酸反应生成二氧化碳气体,所以该反应能鉴定是否含有稀硫酸,故B正确;
C.含有硫酸根离子的溶液都能和氯化钡溶液反应生成白色沉淀,所以该反应不能鉴定是否含有稀硫酸,故C错误;
D.氢氧化钠和硫酸发生中和反应,无明显实验现象,所以该反应不能鉴定是否含有稀硫酸,故D错误;
故答案选AB。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如下图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂。下列说法不正确的是

A. X元素位于周期表中的第16列
B. X的氢化物沸点一定高于Y的氢化物的沸点
C. X、Y、Z元素可以组成一种分子式为Z2Y2X4的化合物,其水溶液中水的电离受到了抑制
D. X、Y、Z元素两两之间均能形成原子个数比为1 : 1的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:

回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是____________。写出操作①的名称:________。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式:__________________________________________。操作②用到的主要仪器名称为______________,其目的是(填序号)________。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和________。若操作③使用如图装置,图中存在的错误是__________________________________________。

(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是________________。 流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,4二氯苯乙酸是生产新型杀虫、杀螨剂螺螨酯的关键中间体,其结构简式如图所示。下列有关说法错误的是( )

A. 该有机物能发生加成反应、取代反应
B. 该有机物的分子式为C8H6Cl2O2
C. 改变氯原子在苯环上的位置,还可得到8种结构
D. 该有机物分子中所有的碳原子可能同时处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100 g 质量分数为46%的乙醇(CH3CH2OH)水溶液中氧原子数为4NA
B. 标况下,46g NO2所含分子数目为NA
C. 1 mol Cl2通入足量NaOH溶液中,转移电子数为2NA
D. 0.5mol/L 的H2SO4溶液中,含有H+的个数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、F均是由短周期元素组成的单质,常温下C是液体, D、F为气体,A、B、E为固体,其中B为淡黄色固体。
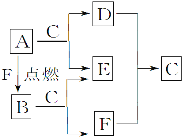
请回答下列问题:
(1)B和E的化学式:B________,E________。
(2)A与C反应的离子方程式为____________________________________________________________。
(3)下列关于A的叙述正确的是________(填序号)。
①A有很强的还原性 ②A的焰色反应呈紫色
③少量A可以保存在冷水里 ④A着火时应选用泡沫灭火器
(4)将A、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积之比是________(填序号)。
①1∶2∶3 ②6∶3∶2 ③3∶1∶1 ④1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:

已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
(1)“预处理”时,需用Na2CO3调节溶液至微酸性而不是碱性,其原因是__________________。
(2)“还原Ⅰ”需在80 ℃条件下进行,适宜的加热方式为____________。
(3)“还原Ⅱ”中,Cu2+参与反应的离子方程式为__________________。
(4)“搅拌”时加入NaCl粉末的作用是____________________________。
(5)“过滤Ⅱ”得到的Cu2Cl2需用无水乙醇洗涤,并在真空干燥机内于70 ℃干燥2小时,冷却,密封包装。于70 ℃真空干燥的目的是__________________________。
(6)①设计从“过滤Ⅰ”所得滤渣中获取Cu的实验方案:稀硫酸加到滤渣中,搅拌,充分反应至无气体产生为止,过滤并用蒸馏水洗涤2~3次,低温烘干。
②现欲测定途径a、b回收铜元素的回收率比,请补充实验方案:____________________,分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1 g,Cu2Cl2的质量为m2 g,则途径a、b铜元素的回收率比为________(铜元素回收率=产品中铜元素质量/废液中铜元素的质量×100%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应
满足的关系是( )
A. c(M+)>c(OH-)>c(A-)>c(H+)B. c(M+)>c(A-)>c(OH-)>c(H+)
C. c(M+)>c(A-)>c(H+)>c(OH-)D. c(M+)>c(H+)>c(A-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com