
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质。下列说法错误的是( )
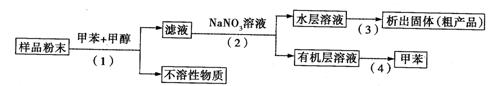
A.步骤(1)需要过滤装置 B.步骤(3)需要用到蒸发皿
C.步骤(4)是利用物质的沸点差异进行分离的
D.活性物质易溶于有机溶剂,难溶于水
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3-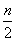 ]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
试剂:1.0 mol·L-1的盐酸、1.0 mol·L-1的KMnO4溶液、0.1 mol·L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水。
(1)聚合硫酸铁中铁元素的化合价是________。
(2)固体产物成分的探究
 实验设计
实验设计
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0 mol·L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0 mol·L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
 思考与判断
思考与判断
根据上面的信息,可以确定固体产物的成分是________;步骤1中发生反应的离子方程式为
______________________________________________________________。
(3)气体产物成分的探究(不考虑水蒸气)
 提出假设
提出假设
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是________。
 设计实验方案,验证假设
设计实验方案,验证假设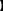
按下表的实验步骤写出预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若____________,则________成立 ②若____________,则________成立 |
| 步骤2:将气体产物缓缓通过浸在冰水中的U形
| 结合上述步骤1的有关结论__________(填①或②) ①若____________,则____成立 ②若____________,则____成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
|
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 |
|
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
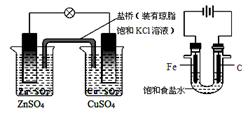
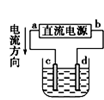
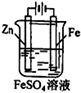
① ② ③ ④
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
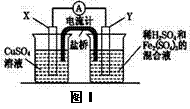 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
(1)写出铜溶于上述混合溶液的离子方程式 。
(2)若在如图Ⅰ所示的装置中发生(1)中的反应,则X极是
 (“正极”或“负极”),电极反应式是
(“正极”或“负极”),电极反应式是
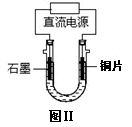
(3)铜完全溶解时,所得溶液中Fe3+、Cu2+、H+三种阳离子的浓
度均为0.2 mol/L(假设溶液体积不变),若用电解方法回收铜,
装置如图Ⅱ所示。
①电解开始阶段,阳极的电极反应式为 ,
阴极的电极反应式为 。
②判断溶液中的Cu2+已完全析出的现象是 。
当Cu2+恰好完全析出时,转移电子的物质的量 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从带中提取碘的实验过程中(萃取剂用苯),涉及到下列操作,
其中正确的是


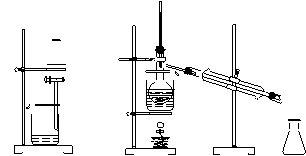

A.将海带灼 B.过滤得含 C.放出碘的 D.分离碘并回收苯
烧成灰 I-溶液 苯溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,
反应的化学方程式如下:
2NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用右图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
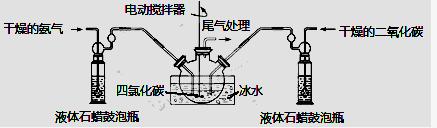
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
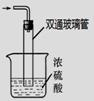
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水 充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
[Mr(NH2COONH4)=78g/mol、Mr(NH4HCO3) =79 g/mol、Mr(CaCO3)=100 g/mol]【来.源:全,
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上有许多方法可以用于
鉴别食盐和“工业盐”,下列方法可行的是:
①加入稀硫酸,微热,看能否产生红棕色气体。②加入酸化的碘化钾淀粉溶液,看溶液是否变蓝。③加入酸化的氯化亚铁溶液,看溶液是否变成棕黄色。④加入酸性高锰酸钾溶液,看能否褪色。⑤加入硝酸酸化的硝酸银溶液,看能否产生白色沉淀。
A.只有①②③④ B.只有②③④⑤ C.只有③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有机物A~I之间的转化关系如图所示:
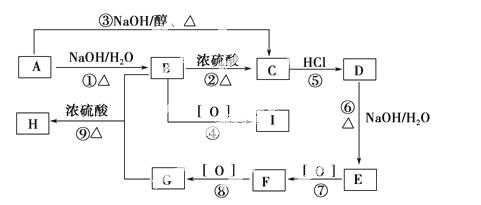
①A与D、B与E、I与F互为同分异构体;
②加热条件下新制Cu(OH)2分别加入到有机物I、F中,I中无明显现象,F中有红色沉淀;
③C的最简式与乙炔相同,且相对分子质量为104;
④B的一种同分异构体与FeCl3溶液发生显色反应。
根据以上信息,回答下列问题:
(1)C中含有的官能团名称为________。
(2)H的结构简式________。
(3)反应①~⑨中属于取代反应的是__________________________________。
(4)写出反应⑥的化学方程式_____________________________________。
(5)写出F与新制Cu(OH)2反应的化学方程式___________________________
_________________________________________________________________。
(6)苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3溶液发生显色反应的G的同分异构体有________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com