
【题目】常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如表所示:
序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 13 |
② | 22.00 | 18.00 | 12 |
③ | 22.00 | 22.00 | 7 |
(1)Ba(OH)2溶液的物质的量浓度为?
(2)x的值是多少?
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时溶液的pH为多少?(已知lg2=0.3)
【答案】
(1)0.05mol/L
(2)1
(3)12.4
【解析】解:(1)根据①知,Ba(OH)2溶液中未加稀盐酸时,溶液的pH=13,则溶液中c(OH﹣)= ![]() mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2]=
mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2]= ![]() ×c(OH﹣)=
×c(OH﹣)= ![]() ×0.1mol/L=0.05mol/L,
×0.1mol/L=0.05mol/L,
故答案为:氢氧化钡物质的量浓度为0.05mol/L;
(2)根据③知,相同体积的氢氧化钡和稀盐酸混合时,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH﹣),因为体积相同,所以酸中c(H+)等于碱中c(OH﹣)为0.1mol/L,所以x=1,
故答案为:x值为1;
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时,Ba(OH)2、NaHCO3的物质的量之比为1:1,二者反应生成碳酸钡沉淀、水和NaOH,设碳酸氢钠的体积为xL,则0.05mol/L×0.1L=0.05mol/L×xL,x=0.1,混合溶液中n(NaOH)=n(NaHCO3)=0.05mol/L×0.1L=0.005mol,c(NaOH)= ![]() =0.025mol/L,溶液中c(H+)=
=0.025mol/L,溶液中c(H+)= ![]() mol/L=4×10﹣13 mol/L,溶液的pH=﹣lgc(H+)=﹣lg4×10﹣13=12.4,
mol/L=4×10﹣13 mol/L,溶液的pH=﹣lgc(H+)=﹣lg4×10﹣13=12.4,
故答案为:混合溶液的pH为12.4.
(1)根据氢氧化钡溶液的pH计算其物质的量浓度;
(2)根据混合溶液的pH=7计算盐酸的w物质的量浓度,然后计算其pH;
(3)根据沉淀量达到最大值的反应方程式计算溶液中氢氧根离子浓度,然后计算pH.


科目:高中化学 来源: 题型:
【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)
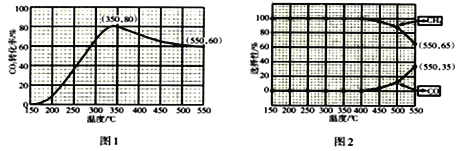
①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
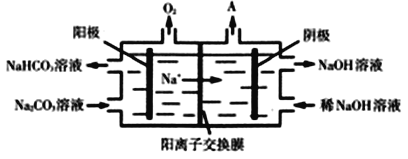
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 | 需除杂的物质 | 试剂 | 操作 |
A | NaCl(Na2CO3) | 稀盐酸 | 蒸发结晶 |
B | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | CO2(CO) | ﹣﹣ | 点燃 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素形成的化合物丰富多彩,试回答下列问题:
(1)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体。
①基态铜原子的核外电子排布式为________________;
②1mol该蓝色晶体的阳离子中含有的σ键的数目为___________;
③简要解释为什么加入乙醇会有晶体析出_____________________________;
(2)已知邻羟基苯胺的结构式为![]() ,比较:邻羟基苯胺的沸点_____________对羟基苯胺的沸点(填“低于”, “高于”, “不确定”);毒奶粉事件中的主角是三聚氰胺,结构简式为
,比较:邻羟基苯胺的沸点_____________对羟基苯胺的沸点(填“低于”, “高于”, “不确定”);毒奶粉事件中的主角是三聚氰胺,结构简式为![]() ,该分子中氮原子的杂化方式为________________;复旦投毒案的主角是N一二甲基亚硝胺,结构简式为
,该分子中氮原子的杂化方式为________________;复旦投毒案的主角是N一二甲基亚硝胺,结构简式为![]() ,则该分子所涉及的第二周期元素第一电离能由小到大的顺序为____________________;
,则该分子所涉及的第二周期元素第一电离能由小到大的顺序为____________________;
(3)已知CuN3中的阴离子与CO2互为等电子体,CuN3晶体的晶胞与氯化钠的晶胞类似。
①请写出CuN3中的阴离子的电子式__________________;
②已知该晶体晶胞边长a,b,c,关系为a=b___________个;
(4)已知NH3,NF3,N(CH3)3都可以与铜离子生成配离子。
①稳定性[Cu(NH3)4]2+__________[Cu(NF3)4]2+。(填“低于”, “高于”,“不确定” )
②已知稳定性[Cu(NH3)4]2+高于[Cu[N(CH3)3]4]2+,请简要解释原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质分别注入水中,振荡后静置,能分层浮于水面的是( )
①苯 ②乙酸乙酯 ③乙醇 ④乙酸 ⑤油脂 ⑥四氯化碳
A. ①②③ B. ①③⑤ C. ①②⑤ D. ①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学通过查阅资料知,NO可与炽热的铜粉发生反应,他们设计如下装置(夹持装置略去)进行实验验证。
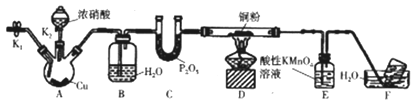
已知:NO能被酸性高锰酸钾溶液氧化生成NO3-。
请回答下列问题:
(1)实验开始前,检查装置气密性的方法是关闭K1、K2,将导管未端置于盛水的水槽中,______________,则表明装置气密性良好;装置A中发生反应的离子方程式为___________________。
(2)装置B的作用为____________________。
(3)装置A中反应开始前,需要先打开K1,向装置中通入一段时间的N2或CO2,其目的是______________________。
(4)实验过程中,装置D中铜粉变黑,装置E中溶液颜色变浅,则装置E中发生反应的离子方程式为_________________________。请设计一种简单的实验方案,证明该离子反应中的氧化产物为NO3-________________________(写出主要的操作过程、现象、结论)。
(5)从绿色化学角度考虑,实验结束后,拆卸装置前,还应进行的一项操作是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,实验式相同,且既不是同系物,又不是同分异构体的是( )
A. 1-辛烯和3-甲基-1-丁烯 B. 苯和乙炔
C. 1-氯丙烷和2-氯丙烷 D. 甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的说法中,正确的是( )
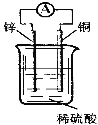
A. 铜片上发生氧化反应
B. 电子由铜片通过导线流向锌片
C. 该装置能将化学能转化为电能
D. 锌片是该装置的正极,该电极反应为Zn+2e—==Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com