

分析 (1)依据基态铁原子的核外电子排布判断未成对电子;铁原子失去最外层电子生成亚铁离子;依据化合价代数和为0写成硫氰合铁配合物的通式;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素;
②价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团;1molFe(CN)32-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个CN-与铁离子形成3个配位键,所以共用6个σ键,1molFe(CN)32-中含有σ键数为6mol;
③依据Fe(CO)3的熔沸点低,且易溶于四氯化碳判断晶体类型;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
②氢键的存在能够显著提高物质的熔沸点;
(4)依据铁铝合金晶胞结构铝原子的数目为4×$\frac{1}{8}$=$\frac{1}{2}$;铁原子数目为1+4×$\frac{1}{8}$=$\frac{3}{2}$,所以铝原子与铁原子个数之比为1:3;
计算一个晶胞的质量m,计算晶胞的体积V,依据ρ=$\frac{m}{V}$计算其密度.
解答 解:(1)基态铁原子的核外电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 4s2,3d6中,最多容纳10个电子,现在有6个,先占据单个的,所以只有2个成对,还有4个未成对;
铁原子失去两个电子变为二价铁离子,其电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 ;
依据化合价代数和为0可知:硫氰合铁通式为:[Fe(SCN)n](3-n)+;
故答案为:4;1s2 2s2 2p6 3s2 3p6 3d6 ;:[Fe(SCN)n](3-n)+;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
故答案为:N>O>C;
②与CN-互为等电子体的一种分子中有2个原子且价电子数为10,可以是CO;
1molFe(CN)63-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个CN-与铁离子形成6个配位键,所以共用12个σ键,1molFe(CN)32-中含有σ键数为12mol,个数为:12NA;
故答案为:CO;12NA;
③Fe(CO)3的熔沸点低,且易溶于四氯化碳,依据分子晶体熔沸点低,且存在相似相溶原理,可知Fe(CO)3为分子晶体;
故答案为:分子晶体;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
故答案为:sp2、sp3;
②乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以乙二胺(H2NCH3CH2NH3)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多;
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)依据铁铝合金晶胞结构铝原子的数目为4×$\frac{1}{8}$=$\frac{1}{2}$;铁原子数目为1+4×$\frac{1}{8}$=$\frac{3}{2}$,所以铝原子与铁原子个数之比为1:3,该铁铝合金的化学式为:AlFe3;
一个小立方体质量为$\frac{27}{2×6.02×1{0}^{23}}$+$\frac{56×3}{2×6.02×1{0}^{23}}$=161.96×10-23g;
所以其密度=$\frac{m}{V}$═$\frac{161.96×1{0}^{-23}g}{0.0289×0.0289×0.0289c{m}^{3}}$=6.71g/cm3;
故答案为:AlFe3;6.71;
点评 本题为结构体,考查了电子的排布、电离能大小的判断、杂化方式的判断、晶胞的相关技术,题目综合性强,难度大,明确晶胞结构是解题关键.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| B. | 常温常压,1.6g甲烷含有的质子数为NA | |
| C. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 往FeCl3溶液中加入Fe粉:2Fe3++Fe═3Fe2+ | |
| C. | 硅酸钠与盐酸反应:SiO32-+2H+═H2 SiO3↓ | |
| D. | 三氧化硫与氢氧化钙溶液的反应:SO3 +2OH-═SO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),其反应路线如图所示,下列有关判断正确的是( )
),其反应路线如图所示,下列有关判断正确的是( )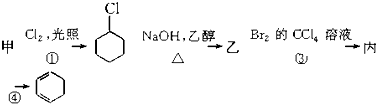
| A. | 甲的化学名称是苯 | |
| B. | 乙的结构简式为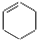 | |
| C. | 反应①为加成反应 | |
| D. | 有机物丙既能发生加成反应,又能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=10-8mol/L | |
| B. | Na2S2O3溶液PH=8的原因用离子方程式表示为S2O32-+2H2O═H2S2O3+2OH- | |
| C. | 生成的沉淀BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 缩小体积使压强增大 | B. | 恒容,充入N2 | ||
| C. | 恒容充入氦气 | D. | 恒压充入氦气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com