(1)目前,我国火力发电厂燃料主要是煤.煤燃烧会排放出SO
2和NO
2,这些气体不仅污染空气,而且与空气中的物质反应后,生成的物质溶于雨水,会形成“酸雨”.请按要求回答下列问题:
①二氧化硫与空气中水份反应生成亚硫酸(H
2SO
3),亚硫酸易与氧气反应生成硫酸.其中亚硫酸与氧气的化学方程式是
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.
②NO
2是一种红棕色气体.在盛有NO
2的集气瓶中放入一块活性炭,过一会儿,瓶内红棕色变淡甚至消失,活性炭具有的这种性质叫做
吸附性
吸附性
.
③对于SO
2和NO
2,小余同学归纳出了如下一些共同点,其中正确的是
A
A
A.都是非金属氧化物 B.硫元素和氮元素化合价都为+2价
C.同温同压下密度相等 D.常温常压下都是有颜色的气体
(2)十.一节放假结束后,小王来到实验室,发现一瓶氢氧化钠固体敞放着,这引起了她的研究欲望.
(提出问题)氢氧化钠是否变质?若发生变质,其程度如何?
(查阅资料)碳酸钠水溶液显碱性,氯化钠、氯化钙水溶液显中性.
(进行试验)Ⅰ.取样品少许,加入稀盐酸有气泡产生;
Ⅱ.取样品少许,加水溶解后,滴入酚酞显红色;
Ⅲ.按如图所示过程,进一步实验:
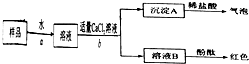
请你与小王同学一道完成下列问题的分析解答:
①氢氧化钠变质的化学反应方程式是
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.
②开始两个步骤中的实验操作a、b,都要使用的两件玻璃仪器是
玻璃棒和烧杯.
玻璃棒和烧杯.
.
③步骤b中,不能用Ca(OH)
2代替CaCl
2的原因是(用化学方程式表示原因):
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,会影响对NaOH存在的判断
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,会影响对NaOH存在的判断
.
④根据上述实验,若直接测定wg样品中氢氧化钠的质量而求其质量分数,须测定的数据是
C
C
A.测定沉淀A 的质量
B.溶液B蒸发溶剂,测定残留固体的质量
C.溶液B与稀硫酸中和,测定消耗H
2SO
4的质量.

 阅读快车系列答案
阅读快车系列答案 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答: