
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为____________________。
(2)电负性最大的是_________________,第一电离能介于Y和Z之间的同周期元素有__________ (填元素符号)。
(3)Y和W的氯化物熔点高的是_________(填化学式),原因是____________________________;与Z的低价氯化物互为等电子体的离子是_____________。
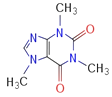
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是_____________________,分子中氮原子的杂化类型有_______________。
(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,试
确定该单元晶胞中含有______个WX,属于__________立方结构(填写面心、简单或体心),晶胞中距离W最近的X有________个。
【答案】 3d64s2 O Mg Si S CaCl2 ;CaCl2属于离子晶体,钙离子和氯离子之间作用大,熔点高, AlCl3属于分子晶体,分子间作用力弱 SO32—或ClO3— 咖啡因与水杨酸钠形成了氢键 sp2 和sp3 4个 面心立方 6
【解析】根据题目所述可知X为O元素,Y是Al元素,Z是P元素,W内层电子数是最外层电子数的9倍,则只能是Ca元素,所以Q为第四周期元素,其基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍,即Q的价层电子排布为3d64s2,所以Q为26号元素Fe。
(1) Fe的基态原子的价层电子排布式为3d64s2;
(2)在这四种元素中,电负性最大的是O元素;根据同周期从左到右第一电离能逐渐增大的变化规律,同时还要考虑ⅡA族的3s2全满状态和ⅤA族3s23p3半满状态的稳定性,得出第一电离能介于Al和P之间的同周期元素有Mg、Si和S三种元素;
(3)由于CaCl2是离子化合物,Ca2+和Cl—之间的离子键作用力大,所以CaCl2的熔点高,而AlCl3是分子晶体,分子间作用力小,所以熔点低;Z的低价氯化物为PCl3,其分子中的最外层电子数为26,与它互为等电子体的离子为SO32—或ClO3—;
(4)水杨酸钠分子中有羟基,而咖啡因分子中有N、O两种吸引电子能力很强的元素,所以二种分子之间可形成氢键,使其溶解度增大;咖啡因分子中N原子有形成双键的sp2杂化,也有形成单键的sp3杂化;
(5) 已知CaO晶体的密度为3.25g/cm3,晶胞边长481pm,则体积为(4.81×10-8)3=1.11×10-22 cm3,所以晶胞的摩尔质量为3.25g/cm3×1.11×10-22 cm3×6.02×1023mol-1=218g/mol,即该晶胞中含有4个CaO;属于面心立方结构,根据面心结构的特点可推知,晶胞中距离Ca2+最近的O2-有6个,分别在Ca2+的前后、上下、左右六个位置上。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、浯化能数据如下:
反应I: NO(g)+O3(g) ![]() NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
反应Ⅱ:SO2(g))+ O3(g)![]() SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g) ![]() 3O2(g) 请回答:
3O2(g) 请回答:
(1)已知反应I在低温下自发进行,则该反应的熵变△S___________0(填“大于”或“小于”)。
(2)其它条件不变,每次向反应器中充入含1.0 mol NO、10 mol SO2的模拟烟气和2.0 molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:
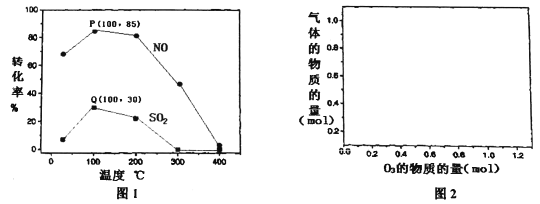
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_________。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是______mol。
③下列说法正确的是_______。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
(3)150℃条件下,向反应器中充入含1molNO、1molSO2的模拟烟气,在图2中分别画出NO和SO2的物质的量随O3量的变化曲线。________
(4)工业上可以通过电解NO制备NH4NO3,原理如图3所示。写出电解过程阳极的电极反应式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去物质杂质所选试剂或方法不正确的是( )
物质 | 所含杂质 | 所用试剂 | 方法 | |
A | O2 | CO2 | NaOH溶液 | 洗气 |
B | FeSO4 | CuSO4 | Fe | 过滤 |
C | 酒精 | 水 | CaO | 蒸发 |
D | KCl | K2CO3 | 盐酸溶液 | 蒸发 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法中正确的是( )
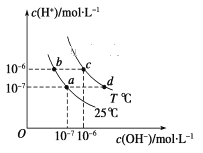
A. 若从a点到c点,可采用在水中加入酸的方法
B. b点对应的醋酸中由水电离的c(H+)=10-6 mol·L-1
C. c点对应溶液的Kw大于d点对应溶液的Kw
D. T ℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Na2CO3 比NaHCO3 的溶解度大
B.Na2CO3 比NaHCO3 稳定
C.物质的量相等的Na2CO3 和NaHCO3 , 前者质量大
D.物质的量相等的Na2CO3 和NaHCO3分别与足量盐酸反应得CO2 的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | 硫酸 | 纯碱 | 硫酸钙 | 氧化铁 |
B | 盐酸 | 烧碱 | 纯碱 | 氧化钙 |
C | 碳酸 | 硫酸钙 | 碳酸钠 | 干冰 |
D | 干冰 | 苛性钠 | 食盐 | 石灰石 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9ClO的同分异构体中能与Na反应放出氢气的共有(不含立体异构)
A. 8 种 B. 9 种 C. 10 种 D. 12 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组拟制备氯气并验证其一系列性质,实验装置如图所示(省略夹持装置)。已知:硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂
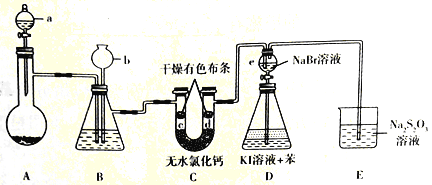
回答下列问题:
(1)仪器a的名称是______,其中盛有浓盐酸,烧瓶A 中盛有的固体试剂是_____(填化学式)。
(2)装置B中盛有饱和NaCl溶液,装置B的作用是________。
a.除去C12中的杂质HCl b.干燥
c.提供后续水蒸气 d.观察装置是否堵塞
(3)c处有色布条褪色,而d处不褪色,这说明__________。
(4)实验结束后,打开e 的活塞,使其中的溶液流人到锥形瓶D中,摇匀锥形瓶,静置后可观察到______________________。
(5)装置E中发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2CO+O2=2CO2,在标准状况下,4.48 L一氧化碳与足量的氧气发生反应,生成的二氧化碳分子个数是__________________。
(2)现有一种泉水样品,1.0 L这种泉水含有4.8×10-2 g Mg2+。那么,该泉水中Mg2+的物质的量浓度是_______________,含1.0 mol Mg2+的这种泉水的体积是_______________升。
(3)如果mg氨气由a个原子构成,则2mg硫化氢中含有的分子数为_____________(用含a的代数式表示)。
(4)0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则单质Ax的化学式是_____________。
(5)现有未知浓度的盐酸25mL,能跟20mL某浓度的氢氧化钠溶液完全反应。若先用0.1g碳酸钙与25mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4mL才能中和。则该盐酸的物质的量浓度为______________,氢氧化钠溶液的物质的量浓度为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com