
| A. | 工业制取硝酸时尾气用氢氧化钠溶液吸收 | |
| B. | 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻到安全区域 | |
| C. | 家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体 | |
| D. | 家中发生天然气泄露时,应立即使用室内电话报警 |
分析 A.烧碱溶液能与NO2和NO反应;
B.肥皂水呈碱性,氯气和碱反应生成盐而降低毒性;
C.次氯酸钙有强氧化性,能氧化浓盐酸生成氯气,氯气是有毒物质;
D.甲烷遇火易发生爆炸.
解答 解:A.烧碱溶液能与NO2和NO反应,所以用烧碱溶液吸收硝酸工业尾气,故A正确;
B.氯气泄漏时,可用蘸有肥皂水的湿毛巾捂住口鼻,原因为肥皂水呈碱性可与氯气反应而降低其毒性,故B正确;
C.漂白粉的成分中有次氯酸钙,能氧化盐酸成氯气,所以两者不能混合使用,故C正确;
D.天然气泄漏时,应立即关闭天然气开关,然后到距离泄漏处较远的地方报警,而不能用室内电话报警,因为天然气的成分为甲烷,遇火发生爆炸,故D错误.
故选D.
点评 本题考查实验安全,明确物质的性质是解本题关键,会运用化学知识解释生活现象,难度不大.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的浓度为0.4 mol•L-1 | B. | X2、Z的浓度均为0.15 mol•L-1 | ||
| C. | X2与Z的浓度之和为0.4 mol•L-1 | D. | X2的浓度为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 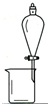 用CCl4提取溴水中的Br2 用CCl4提取溴水中的Br2 | B. | 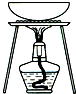 从KI和I2的固体混合物中回收I2 从KI和I2的固体混合物中回收I2 | ||
| C. | 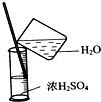 稀释浓硫酸 稀释浓硫酸 | D. | 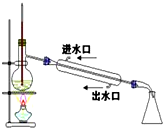 工业酒精制备无水酒精 工业酒精制备无水酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3、H2S、CO2 | B. | H2O、NH3•H2O、HClO | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | Cu(OH)2CH3COOH、C2H5OH、CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,NaClO属于离子(离子、共价)化合物.
,NaClO属于离子(离子、共价)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 60mL | C. | 20mL | D. | 0mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com