
| A、在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | ||
| B、由“C(石墨)=C(金刚石);△H=+119kJ?mol-1”可知,金刚石比石墨稳定 | ||
| C、在稀溶液中:H+(aq)+OH q)=H2O(l);△H=-57.3l kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ | ||
D、在101KPa时,2g H2生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、实验室制Fe(OH)2时应将汲有NaOH溶液的胶头滴管伸入FeSO4溶液液面下,缓缓挤出碱液 |
| B、镁铝合金的硬度和熔点都比纯铝和纯镁大 |
| C、结晶形和无定形二氧化硅统称硅石 |
| D、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而常温耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ?mol-1,反应物总能量>生成物总能量 |
| B、相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.则2E1>E2 |
| C、l0lkPa 时,2H2(g)+O2(g)=2H2O(1);△H=-571.6kJ?mol-1,H2的燃烧热为571.6kJ/mol |
| D、H+ (aq)+OH-(aq)=H2O(l);△H=-57.3kJ?mol-1,含 1molNaOH 的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①② | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16 mol NH3 |
| B、8 mol NH3 |
| C、4 mol NH3 |
| D、3 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可逆反应A(s)+B(g)?n C (g)△H=Q (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示.下列有关叙述中一定正确的是( )
可逆反应A(s)+B(g)?n C (g)△H=Q (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示.下列有关叙述中一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b没有使用催化剂 |
| B、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| C、其他条件相同,若只改变温度,则a比b的温度高且Q>0 |
| D、其他条件相同,a表示减少A的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
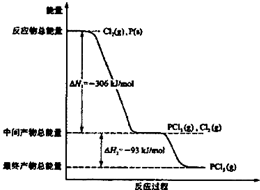 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(如图中的△H表示生成lmol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(如图中的△H表示生成lmol产物的数据).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com