
| A. | 混合液中c(SO${\;}_{4}^{2-}$)为0.04 mol•L-1 | |
| B. | 原Al2(SO4)3溶液中c(Al3+)与100 mL 0.02 mol•L-1 Al(NO3)3中c(Al3+)相等 | |
| C. | 混合后的溶液中含有0.003 mol Na+ | |
| D. | 混合后溶液中c(Na+)为0.02 mol•L-1 |
分析 A.利用n=cV来计算硫酸根离子的物质的量,再计算混合后硫酸根离子的浓度;
B.利用溶液的浓度及物质的化学式来分析c(Al3+);
C.利用n=cV来计算钠离子的物质的量,混合前后钠离子的物质的量不变;
D.利用n=cV来计算钠离子的物质的量,再利用混合物的总体积来计算浓度.
解答 解:A.SO42-的物质的量为0.1L×0.03mol/L+0.05L×0.02mol/L×3=0.006mol,c(SO42-)=$\frac{0.006mol}{0.15L}$=0.04mol?L-1,故A正确;
B.原Al2(SO4)3溶液中c(Al3+)=0.02mol/L×2=0.04mol/L,100mL0.02mol?L-1Al(NO3)3中c(Al3+)=0.02mol/L,二者不相等,故B错误;
C.100mL0.03mol/LNa2SO4溶液中Na+的物质的量为:0.1L×0.03mol/L×2=0.006mol,混合前后钠离子的物质的量不变,仍为0.006mol,故C错误;
D.Na+的物质的量为:0.03mol•L-1×2×0.1L=0.006mol,混合后溶液的体积为0.15L,则混合液中c(Na+)=$\frac{0.006mol}{0.15L}$=0.04mol?L-1,故D错误;
故选A.
点评 本题考查物质的量浓度及物质的量的有关计算,题目难度中等,明确计算公式及混合前后溶质或离子的量的关系是解答的关键,并注意利用化学式来判断离子的数目.


科目:高中化学 来源: 题型:解答题
 ;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为
;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为 ;
;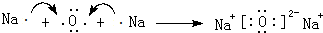 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和NaOH溶液 | B. | 稀H2S04和Ba(OH)2溶液 | ||
| C. | AgNO3溶液和NaCl溶液 | D. | H20和CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L的NaCl | B. | 75mL 3mol/L的NH4Cl | ||
| C. | 150mL 2mol/L的KCl | D. | 75mL 2mol/L的CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③ | B. | ③④ | C. | 全部 | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )| A. | 无法给出实验中产生H2的物质的量 | |
| B. | 欲给出a的取值范围尚缺少一个条件 | |
| C. | 无法认定Mg、Al合金中$\frac{n(Mg)}{n(Al)}$的最大值 | |
| D. | 溶解“一定量Mg、Al合金”的HCl溶液的体积为90mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26.8g | B. | 28.7g | C. | 29.1g | D. | 29.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3与FeO的物质的量之比为1:6 | |
| B. | 硝酸的物质的量浓度为3.0 mol/L | |
| C. | 产生的NO在标准状况下的体积为4.48 L | |
| D. | Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 验方法 | 沉淀法 | 显色法 | 气体法 |
| 判断的依据 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | CO32---气体法 | B. | SO42---沉淀法 | C. | H+--显色法 | D. | Cl---气体法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com