
����Na2S2O8������ǿ������SO4﹣•�����ɻ��������л���Ⱦ����Ŀǰ���DZ���ĸ��������������ױ���ij������̽��pH����������Na2S2O8��Ũ�ȶԽ���2��4﹣DMAP��2��4﹣﹣�����ӣ�Ч�ʵ�Ӱ�죮
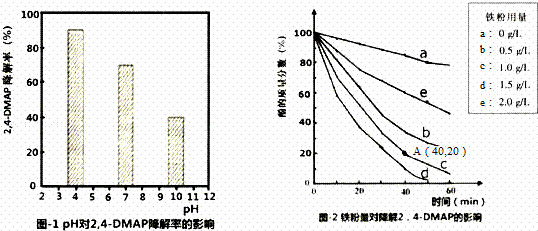
��1��̽����Һ����Ե�Ӱ�죺��������2��4﹣DMAP���뵽��ͬpH��Na2S2O8��Һ�У������ͼ1��ʾ���ɴ˿�֪����Һ������ǿ�� ��������ڡ������ڡ���Na2S2O8����SO4﹣•��
��2��̽������������Ӱ�죺
��ʵ��ǰ������0.1mol•L﹣1 H2SO4ϴ��Fe�ۣ���Ŀ���� ����������ˮϴ�������ԣ�
����ͬ�����£�ȡ��ͬ������������۷ֱ����c��2��4﹣DMAP��=1.0��10 ﹣3mol•L﹣1��c��Na2S2O8��=4.2��10﹣3mol•L﹣1�Ļ����Һ�У�ʵ������ͼ2��ʾ�����н���Ч����õ�����������1.5g/L������ӷ�Ӧ��ʼ��A��ʱ��2��4﹣DMAP�����ƽ����Ӧ����Ϊ �����Է�Ӧ��������Һ�������仯����
����֪��2Fe+O2+2H2O=2Fe2++4OH﹣��S2O8﹣+Fe2+=SO4﹣+SO42﹣+Fe3+������ܻᷢ����SO4﹣+Fe2+=SO42﹣+Fe3+�������ۼ���������ʱ��2��4﹣DMAP�Ľ����ʷ����½���ԭ������ǣ������ӷ���ʽ��ʾ���� ��
��3��̽��Na2S2O8Ũ�ȵ�Ӱ�죺��д�±��пո����ʵ�鷽����
��š������� M��Fe�ۣ�/g V/mL V/mL �ռ����ݺ͵ó�����
1 100 0.3 50 50
2 100V����ˮ��/mL 0.3
���㣺 ����ʵ�鷽������ƣ�
������ ��1��������������ͬ����4﹣CP���뵽��ͬpH��Na2S2O8��Һ�У�����ͼ��֪����Һ��pHԽС��4﹣CP������Խ��
��2�����������������������ɳ�ȥ��
�ھ�ͼ����������Ч����õ�����������d���ߣ���1.5gʱ��c��2��4﹣DMAP��=1.0��10 ﹣3mol•L﹣1������1L��Һ������2��4﹣﹣�����ӵ�����Ϊ1.0��10 ﹣3mol•L﹣1��122g/mol=0.122g�����A��ʱ������������20%���㷴Ӧ���ʣ�
��Fe�ܹ��������ӷ�Ӧ�����������ӣ����������ܹ���ǿ������SO4﹣•�����ɻ�����ԭ��
��3��̽��Na2S2O8Ũ�ȵ�Ӱ�죬Ӧʹ��������Ũ�Ⱥ�������ͬ��Na2S2O8Ũ�Ȳ�ͬ���۲�����ͬʱ����2��4﹣DMAP��Ũ�ȱ仯��
��� �⣺��1��������������ͬ����4﹣CP���뵽��ͬpH��Na2S2O8��Һ�У�����ͼ��֪����Һ��pHԽС��4﹣CP������Խ��������Һ������ǿ������Na2S2O8����SO4﹣•���ʴ�Ϊ�������ڣ�
��2��H2SO4���Գ�ȥFe�۱���������
�ʴ�Ϊ��ȥ�����۱��������������ʣ�
�ھ�ͼ����������Ч����õ�����������d���ߣ���1.5g/Lʱ��������1L��Һ������2��4﹣�������ӵ�����Ϊ1.0��10 ﹣3mol•L﹣1��122g/mol=0.122g��A��ʱ������80%��Ϊ0.0976g�����ʵ���Ϊ0.0008mol������40minʱ�ķ�Ӧ����Ϊ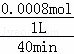 =2.0��10﹣5mol/��L•min�����ʴ�Ϊ��1.5��2.0��10﹣5mol/��L•min����
=2.0��10﹣5mol/��L•min�����ʴ�Ϊ��1.5��2.0��10﹣5mol/��L•min����
��Fe�ܹ��������ӷ�Ӧ�����������ӣ����������ܹ���ǿ������SO4﹣•�����ɻ�����ԭ����Ӧ�����ӷ���ʽΪFe+2Fe3+=3Fe2+��SO4﹣+Fe2+=SO42﹣+Fe3+��
��3��̽��Na2S2O8Ũ�ȶԶԽ���2��4﹣DMAP��2��4﹣﹣�����ӣ�Ч�ʵ�Ӱ�죬Ӧʹ��������Ũ�Ⱥ�������ͬ��Na2S2O8Ũ�Ȳ�ͬ���۲�����ͬʱ����2��4﹣DMAP��Ũ�ȱ仯�����Լ������50mL��0.05mol��L﹣1Na2S2O8��Һ��������50mL��0.05mol��L﹣1Na2S2O8��Һ������Һ�����ҪΪ100mL����Na2S2O8��Һ��ˮ�����֮��Ϊ100mL������30mLNa2S2O8��Һ��70mLˮ���ռ������ݺ͵ó��Ľ����ǣ�����ͬʱ����2��4﹣DMAP��Ũ�ȱ仯��ͬ����˵��Na2S2O8Ũ�ȶ�2��4﹣DMAP��������Ӱ�죬��2��4﹣DMAP��Ũ�ȱ仯����ͬ����˵��Na2S2O8Ũ�ȶ�2��4﹣DMAP��������Ӱ�죬�ʴ�Ϊ��
��š������� M��Fe�ۣ�/g V/mL V/mL �ռ����ݺ͵ó�����
1 ����ͬʱ����2��4﹣DMAP��Ũ�ȱ仯��ͬ����˵��Na2S2O8Ũ�ȶ�2��4﹣DMAP��������Ӱ�죬��2��4﹣DMAP��Ũ�ȱ仯����ͬ����˵��Na2S2O8Ũ�ȶ�2��4﹣DMAP��������Ӱ�죮
2 30 70
��
������ ���⿼��̽��ʵ�飬���ؿ���ѧ����ȡ��Ϣ���ӹ���Ϣ��������Ϣ�������������֪��ͼ�����ݺ�����ĺ��弰�仯���ƣ�֪��ʵ��Ŀ�ļ�ԭ������Ŀ�ѶȲ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
50mL��������Ϊ35%���ܶ�Ϊ1.24g/mL�������У���������ʵ���Ũ��Ϊ����
A�� 0.044mol/L B�� 0.44mol/L C�� 4.4mol/L D�� 44mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����л�ѧ��Ӧ���������˵����ȷ���ǣ���
A�� ���ȷ�Ӧ����ʱ���ؼ���
B�� ��ѧ��Ӧ������һ���������仯
C�� ���ȷ�Ӧ��Ҫ���Ⱥ���ܷ���
D�� ��ѧ��Ӧ���ջ�ų������Ķ�����μӷ�Ӧ�����ʵĶ����й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����Ȼ�ѧ����ʽ����H2��g��+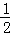 O2 ��g��=H2O��l������H=﹣285kJ•mol﹣1
O2 ��g��=H2O��l������H=﹣285kJ•mol﹣1
��H2��g��+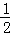 O2 ��g��=H2O��g������H=﹣241.8kJ•mol﹣1
O2 ��g��=H2O��g������H=﹣241.8kJ•mol﹣1
��C��s��+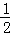 O2 ��g��=CO��g������H=﹣110.5kJ•mol﹣1
O2 ��g��=CO��g������H=﹣110.5kJ•mol﹣1
��C��s��+O2 ��g��=CO2��g������H=﹣393.5kJ•mol﹣1
�ش��������⣺
��1��H2��ȼ���ȡ�HΪ ��C��ȼ���ȡ�HΪ ��
��2��ȼ��1g H2����Һ̬ˮ���ų�������Ϊ KJ��
��3��д��COȼ�յ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ���׳ص��ܷ�ӦʽΪN2H4+O2=N2+2H2O��������˵����ȷ���ǣ���
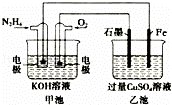
A�� �׳��и����ϵĵ缫��ӦʽΪN2H4﹣4e﹣=N2+4H+
B�� �ҳ���ʯī�缫�Ϸ����ķ�ӦΪ4OH﹣﹣4e﹣=2H2O+O2��
C�� �׳���ҺpH�����ҳ���ҺpH��С
D�� �׳���ÿ����0.1mol N2H4�ҳص缫���������6.4g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
4A��s��+3B��g��═2C��g��+D��g������2min��B��Ũ�ȼ���0.6mol•L﹣1���Դ˷�Ӧ���ʵı�ʾ��ȷ���ǣ���
A�� ��A��ʾ�ķ�Ӧ������0.4mol•L﹣1•min﹣1
B�� �ֱ���B��C��D��ʾ��Ӧ���ʣ����ֵ��3��2��1
C�� ��2minĩ�ķ�Ӧ���ʣ���B��ʾ��0.3mol•L﹣1•min﹣1
D�� ��2min�ڵķ�Ӧ���ʣ���C��ʾ��0.3mol•L﹣1•min﹣1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���ǣ���
A�� ��֪2H2��g��+O2��g��=2H2O��g����H=﹣483.6 kJ•mol﹣1����������ȼ����Ϊ241.8 kJ•mol﹣1
B�� ��֪NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l����H=﹣57.3 kJ•mol﹣1����40.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�С��57.3kJ������
C�� ��֪2C��s��+2O2��g��=2CO2��g ����H=a��2C��s��+O2��g��=2CO��g������H=b����a��b
����H=a��2C��s��+O2��g��=2CO��g������H=b����a��b
D�� ��֪C��ʯī��s��=C�����ʯ��s����H��0����ʯī�Ƚ��ʯ�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪2H2��g��+O2��g��═2H2O��l����H=﹣571.6kJ•mol﹣1 CO��g��+ O2��g��=CO2��g����H=﹣283kJ•mol﹣1ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74kJ������ͬʱ����3.6gҺ̬ˮ����ԭ���������H2��CO�����ʵ�����
O2��g��=CO2��g����H=﹣283kJ•mol﹣1ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74kJ������ͬʱ����3.6gҺ̬ˮ����ԭ���������H2��CO�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ����H1=﹣393.5kJ•mol﹣1����H2=﹣395.4kJ•mol﹣1������˵�����ʾʽ��ȷ���ǣ���
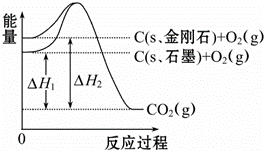
A�� C��s��ʯī��═C��s�����ʯ����H=+1.9 kJ•mol﹣1
B�� ʯī�ͽ��ʯ��ת���������仯
C�� ���ʯ���ȶ���ǿ��ʯī
D�� 1 molʯī��������1 mol���ʯ����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com