
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是

A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.外电路的电流方向是从a到b
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学三类分散系及比较(解析版) 题型:选择题
下列有关分散系的说法正确的是
A.一种分散系中可以有一种分散质,也可以有多种分散质
B.浊液的分散质都能通过过滤从分散剂中分离出来
C.分散剂一定是液体
D.同一种溶质的饱和溶液要比不饱和溶液的浓度大
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
有关AgCl的沉淀溶解平衡的说法正确的是
A.AgCl沉淀生成和溶解同时在不断进行,且速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.用等体积的蒸馏水和0.01mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失小于用稀盐酸洗涤的损失量。
D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+物质的量浓度(mol·L-1)为
A. B.
B. C.
C.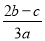 D.
D.
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:简答题
【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为 ;
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
下列关于有机物的叙述不正确的是
A.甲烷、甲苯、乙醇、乙酸都可以发生取代反应
B.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏制取
C.乙酸乙酯在无机酸或碱存在时都能发生水解反应
D.淀粉、纤维素、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:

(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是 ;
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的 ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式 ;
③Ⅲ中加入MnSO4的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是
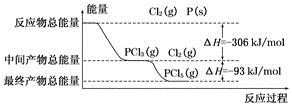
A.其他条件不变,升高温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热 ΔH=-798 kJ/mol
C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)===2PCl3(g) ΔH=-306 kJ/mol
D.其他条件不变,对于2PCl5(g)===2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com