
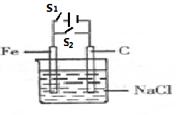
| A.断开S1,闭合S2,C电极上发生的反应为O2+4e-+4H+=2H2O |
| B.断开S1,闭合S2,Fe电极作原电池的负极,发生还原反应。 |
| C.闭合S1,断开S2,溶液中的Cl- 向C电极方向移动。 |
| D.闭合S1,断开S2,阳极本身失电子,被氧化。 |
科目:高中化学 来源:不详 题型:单选题
| A.a>c>d>b | B.c>a>b>d |
| C.a>c>b>d | D.c>a>d>b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.2I- - 2e- = I2;碘遇淀粉变蓝 |
| B.Cu - 2e- = Cu2+;Cu2+显蓝色 |
| C.2Cu + 4I-- 4e- =" 2CuI↓" + I2; 碘遇淀粉变蓝 |
| D.4OH-- 4e- = 2H2O + O2;O2将I-氧化为I2,碘遇淀粉变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
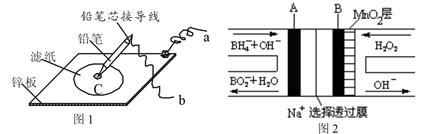
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.构成原电池正极和负极的材料必须是两种金属? |
| B.由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu上产生气泡? |
| C.氢氧燃料电池中,把H2通入正极,此极发生氧化反应 |
| D.在锌铜原电池外电路中,电子由锌流向铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
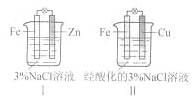
| A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com