
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+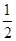 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
| A.CO的燃烧热为283 kJ/mol |
B.下图可表示由CO生成CO2的反应过程和能量关系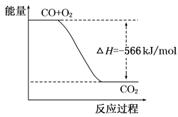 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
B
解析试题分析:A、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol可知,CO的燃烧热=566 kJ/mol ×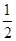 =283 kJ/mol,A正确;B、CO燃烧是放热反应,反应物的总能量高于生成物的总能量,即2molCO和1mol氧气的总能量比2molCO2的总能量高566kJ。但图像中物质的物质的量不对,因此右图不能表示由CO生成CO2的反应过程和能量关系,B不正确;C、由于气态CO2的总能量高于固态CO2的总能量,所以过氧化钠与固态CO2反应放出的热量少。由于放热越多,△H越小,所以根据Na2O2(s)+CO2(g)=Na2CO3(s)+
=283 kJ/mol,A正确;B、CO燃烧是放热反应,反应物的总能量高于生成物的总能量,即2molCO和1mol氧气的总能量比2molCO2的总能量高566kJ。但图像中物质的物质的量不对,因此右图不能表示由CO生成CO2的反应过程和能量关系,B不正确;C、由于气态CO2的总能量高于固态CO2的总能量,所以过氧化钠与固态CO2反应放出的热量少。由于放热越多,△H越小,所以根据Na2O2(s)+CO2(g)=Na2CO3(s)+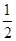 O2(g) ΔH=-226 kJ/mol可知,2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol,C正确;D、已知①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol、②Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g) ΔH=-226 kJ/mol可知,2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol,C正确;D、已知①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol、②Na2O2(s)+CO2(g)=Na2CO3(s)+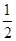 O2(g) ΔH=-226 kJ/mol,则根据盖斯定律可知①×
O2(g) ΔH=-226 kJ/mol,则根据盖斯定律可知①×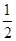 +②即得到Na2O2(s)+CO(g)=Na2CO3(s),所以该反应的反应热△H=-566 kJ/mol×
+②即得到Na2O2(s)+CO(g)=Na2CO3(s),所以该反应的反应热△H=-566 kJ/mol×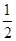 -226 kJ/mol=-509kJ/mol。在反应中碳元素化合价从+2价升高到+4价,失去2个电子。因此CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023,D正确,答案选B。
-226 kJ/mol=-509kJ/mol。在反应中碳元素化合价从+2价升高到+4价,失去2个电子。因此CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023,D正确,答案选B。
考点:考查反应热的计算、盖斯定律的应用、氧化还原反应的判断以及图像识别


科目:高中化学 来源: 题型:单选题
已知在1×105Pa,298K条件下,1mol氢气燃烧生成水蒸气放出242kJ热量,下列热化学方程式正确的是
| A.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1 |
| B.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据以下三个热化学反应方程式:2H2S(g)+3O2(g) =2SO2(g)+2H2O(l)  H= -Q1 kJ/mol;
H= -Q1 kJ/mol;
2H2S(g)+O2(g) =2S(s) +2H2O(l) 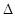 H= -Q2kJ/mol;
H= -Q2kJ/mol;
2H2S(g)+O2(g) =2S(s)+2H2O(g) 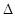 H= -Q3kJ/mol。
H= -Q3kJ/mol。
判断Q1、Q2、Q3三者关系正确的是
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,正确的是( )
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.放热反应不需要加热就可以发生 |
| C.反应条件为加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H﹤0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知H-H、Cl-Cl和H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1,请用此数据估计,由Cl2、H2生成2mol H-Cl 时的热效应△H等于( )
| A.-183 kJ·mol-1 | B.-91.5kJ·mol-1 |
| C.+183kJ·mol-1 | D.+ 91.5kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 |
| C.1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ。 |
| D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l)ΔH="-57.3" kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下列热化学方程式:
Zn(s)+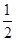 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
Hg(l)+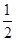 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是 ( )
| A.-441.8 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-260.4 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com