
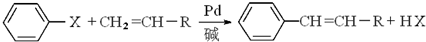 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)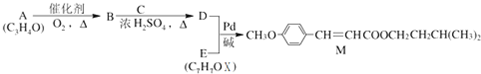
 ,D为CH2═CHCOOCH2CH2CH(CH3)2,A发生氧化反应生成B,B与C反应生成D,结合A的分子式与D的结构,可推知B为CH2═CH-COOH,C为HOCH2CH2CH(CH3)2,则A为CH2═CH-CHO,据此解答.
,D为CH2═CHCOOCH2CH2CH(CH3)2,A发生氧化反应生成B,B与C反应生成D,结合A的分子式与D的结构,可推知B为CH2═CH-COOH,C为HOCH2CH2CH(CH3)2,则A为CH2═CH-CHO,据此解答. ,D为CH2═CHCOOCH2CH2CH(CH3)2,A发生氧化反应生成B,B与C反应生成D,结合A的分子式与D的结构,可推知B为CH2═CH-COOH,C为HOCH2CH2CH(CH3)2,则A为CH2═CH-CHO,
,D为CH2═CHCOOCH2CH2CH(CH3)2,A发生氧化反应生成B,B与C反应生成D,结合A的分子式与D的结构,可推知B为CH2═CH-COOH,C为HOCH2CH2CH(CH3)2,则A为CH2═CH-CHO, ,D为CH2═CHCOOCH2CH2CH(CH3)2,
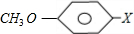
,D为CH2═CHCOOCH2CH2CH(CH3)2, ;CH2═CHCOOCH2CH2CH(CH3)2;
;CH2═CHCOOCH2CH2CH(CH3)2; ,K与过量NaOH溶液共热,酚羟基与碱发生中和反应,-X原子在氢氧化钠水溶液、加热条件发生取代反应,发生反应的方程式为
,K与过量NaOH溶液共热,酚羟基与碱发生中和反应,-X原子在氢氧化钠水溶液、加热条件发生取代反应,发生反应的方程式为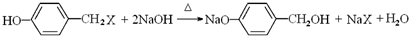 ,
,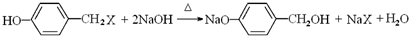 .
.


科目:高中化学 来源: 题型:
| A、SO2(氧化物) |
| B、稀硫酸(电解质) |
| C、HNO3(含氧酸) |
| D、氯水(混合物) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、键长相同,两个键之间夹角为109°28′ |
| B、N-H键为极性共价键 |
| C、4个N-H键的键能、键长相同 |
| D、N-H原子间存在配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
| B、常温下,pH=4的溶液一定是酸溶液 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D、在滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2溶液有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
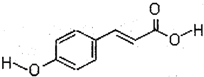 [化学一选修/有机化学基础]
[化学一选修/有机化学基础]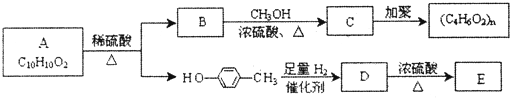
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
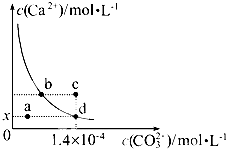 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )| A、加入蒸馏水可使溶液由d点变到a点 |
| B、c点时有碳酸钙沉淀生成 |
| C、x数值为2×10-5 |
| D、b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③②①④ |
| C、④③①② | D、③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Mn2+ |
| Mn2+ |
| Mn2+ |
| C2O42- |
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪 色时间 (s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com