
下列分类不正确的是 ( )
A.纯碱、烧碱均属碱类 B.CO2、SO2均属酸性氧化物
C.醋酸、硫酸、硝酸均属酸类
D.Na2CO3、Na2SO3、NaCl都属钠盐
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
(1)已知:重铬酸根离子(Cr2O72—)是橙红色的,铬酸根离子(CrO42-)是黄色的,重铬酸钾溶于水发生反应:Cr2O72-+H2O  2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
。
 (2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(3)将NO2和N2O4混合气体置于恒容密闭容器中,将该体系升温至100oC,此时的现象是_________________________,原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);ΔH = + Q kJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比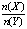 的关系如图。改变温度和压强,生成物Z的百分含量如表,则该反应的化学方程式可表示为
的关系如图。改变温度和压强,生成物Z的百分含量如表,则该反应的化学方程式可表示为
| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
A.3X(g)+Y(g) 4Z(g);ΔH>0 B.X(g)+3Y(g)
4Z(g);ΔH>0 B.X(g)+3Y(g) 4Z(g);ΔH>0
4Z(g);ΔH>0
C.3X(g)+Y(g) 3Z(g);ΔH<0 D.X(g)+3Y(g)
3Z(g);ΔH<0 D.X(g)+3Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、
2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 。(选填“正反应方向”、“逆反应方向”、“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.氢氧化钠溶液和稀盐酸反应:H++OH-===H2O
B.大理石与盐酸反应制取二氧化碳:CO32-+ 2H+=== H2O + CO2↑
C.铁粉投入FeCl3溶液中:Fe + Fe3+===2Fe2+
D.用小苏打治疗胃酸过多:CO32-+ 2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或事故处理正确的是 ( )
A.金属Na着火,立即用水扑灭 B.实验结束后,用嘴吹灭酒精灯
C.皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能获得成功的是
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.苯与浓溴水反应制取溴苯
C.向浓溴水中加几滴苯酚观察沉淀
D.1 mol·L-1 CuSO4溶液2 mL和0.5 mol·L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管2,再测试管2中有机层的厚度,实验记录如下:
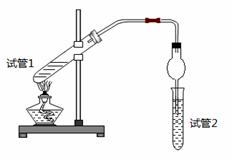
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
(1)写出实验A中试管1反应的化学方程式________________________________。
(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
(3)分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 ___ 。
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 ____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com